Enligt professor Dr. Le Van Quang, chef för K Hospital, kommer enheten snart att introducera Pembroria-medicin i behandlingsregimen för cancerpatienter. Läkemedlet Pembroria (Ryssland) produceras och kostar cirka 18 miljoner dong per flaska. Patienter använder vanligtvis två flaskor i en kur. Behandlingskuren varar från 12 till 24 kurer, eller tills patienten inte längre svarar på läkemedlet. För närvarande täcks läkemedlet inte av sjukförsäkringen .
Enligt en representant för läkemedelsmyndigheten ( hälsoministeriet ) har Pembroria slutfört kliniska studier och har officiellt godkänts för cirkulation i Vietnam. Läkemedlet produceras av Biocad (Ryssland), registrerat av ett företag med huvudkontor i Förenade Arabemiraten. Licensen tillåter import, distribution och stor användning av läkemedlet och tillhör inte gruppen specialläkemedel eller läkemedel som omfattas av restriktioner.
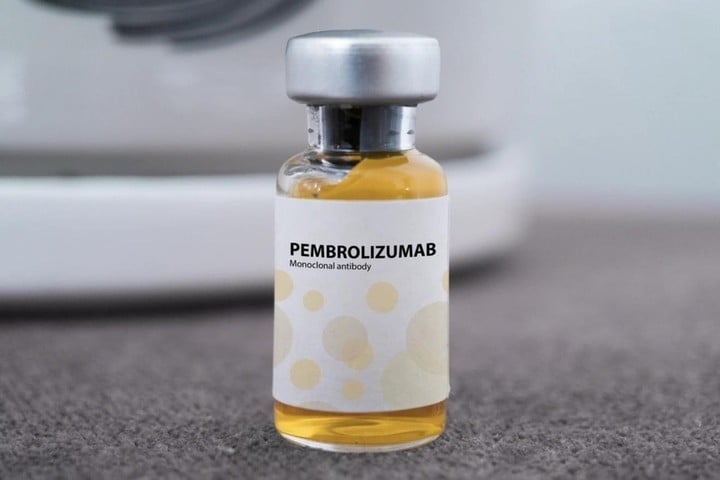
I huvudsak är Pembroria en "biosimilar" till Keytruda - originalprodukten utvecklad av MSD (USA), som också innehåller den aktiva ingrediensen Pembrolizumab. Detta är en monoklonal antikropp som hjälper immunförsvaret att känna igen och förstöra cancerceller, och anses vara en av de mest effektiva immunterapierna idag. Keytruda godkändes av USA 2014 och fick licens för cirkulation i Vietnam 2017.
Pembrorias framväxt förväntas ge cancerpatienter större tillgång till behandling, då kostnaden är betydligt lägre – cirka 18 miljoner VND per injektionsflaska, jämfört med 55–65 miljoner VND för Keytruda. Men båda dessa läkemedel täcks fortfarande inte av sjukförsäkringen.
Pembrolizumab verkar genom "snabb frisättning" till T-immunceller. Normalt sett, cancerceller skickar en "stopp"-signal som hindrar T-celler från att attackera. Läkemedlet blockerar denna signal och återaktiverar förmågan att förstöra tumörer, vilket är effektivt mot många typer av cancer, såsom lung-, njur-, livmoderhals-, melanom...
Enligt Läkemedelsverket lämnades hela licensdokumentationen för läkemedel in av företaget i enlighet med föreskrifterna. År 2024 hade detta läkemedel slutfört kliniska studier. Företaget fortsatte dock att genomföra en immunogenicitetsbedömning – ett obligatoriskt krav för biosimilarer som denna produkt, inte en ny klinisk prövning.
Under cirkulationsprocessen är företagen ansvariga för att övervaka och regelbundet rapportera om läkemedlets säkerhet, effektivitet och immunogenicitet efter 3 eller 5 år, enligt krav från hanteringsmyndigheten.
Tidigare var många läkemedel innehållande den aktiva substansen Pembrolizumab godkända för cirkulation i landet. Läkemedelsverkets beslut 628/QD-QLD daterat 31 oktober godkände 14 vacciner och biologiska produkter, inklusive Pembroria (100 mg/4 ml), koncentrerad infusionslösning, med ett utgångsdatum på 24 månader från tillverkningsdatum.
Källa: https://baolangson.vn/thuoc-ung-thu-pembroria-cua-nga-vua-duoc-cap-phep-tai-viet-nam-co-gia-bao-nhieu-5064810.html



![[Foto] Generalsekreterare To Lam besöker Long Thanh International Airport-projektet](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1763008564398_vna-potal-tong-bi-thu-to-lam-tham-du-an-cang-hang-khong-quoc-te-long-thanh-8404600-1261-jpg.webp)



![[Foto] "Ärren" i Da Nangs berg och skogar efter stormar och översvämningar](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1762996564834_sl8-jpg.webp)

















































































![Övergången till Dong Nai OCOP: [Artikel 3] Koppla samman turism med konsumtion av OCOP-produkter](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Kommentar (0)