K Hastanesi Direktörü Profesör Dr. Le Van Quang'a göre, ünite yakında şu hizmetleri sunacak: Pembroria ilacı Kanser hastalarının tedavi rejiminde. Pembroria (Rusya) ilacı, şişe başına yaklaşık 18 milyon VND'ye mal oluyor ve hastalar genellikle bir kürde iki şişe kullanıyor. Tedavi süresi 12 ila 24 kür veya hasta ilaca artık yanıt vermeyene kadar sürüyor. İlaç şu anda sağlık sigortası kapsamında değil.
İlaç Dairesi ( Sağlık Bakanlığı ) temsilcisine göre, Pembroria klinik çalışmalarını tamamlamış ve Vietnam'da dolaşıma girmesi için resmi lisans almıştır. İlaç, merkezi BAE'de bulunan bir şirket tarafından tescil edilen Biocad (Rusya) tarafından üretilmektedir. Lisans, ilacın ithal edilmesine, dağıtılmasına ve yaygın olarak kullanılmasına olanak sağlamakta olup, özel veya kısıtlı ilaçlar grubunda yer almamaktadır.
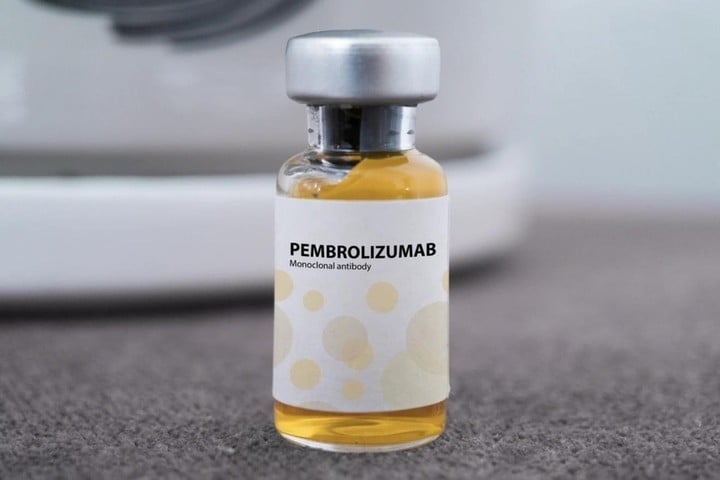
Pembroria, özünde, MSD (ABD) tarafından geliştirilen ve aynı zamanda aktif bileşen Pembrolizumab içeren orijinal ürün olan Keytruda'nın bir "biyobenzeri"dir. Bu, bağışıklık sisteminin kanser hücrelerini tanımasına ve yok etmesine yardımcı olan ve günümüzün en etkili immünoterapilerinden biri olarak kabul edilen bir monoklonal antikordur. Keytruda, 2014 yılında ABD tarafından onaylanmış ve 2017 yılında Vietnam'da dolaşıma girmesi için lisanslanmıştır.
Pembroria'nın piyasaya sürülmesinin, maliyetin önemli ölçüde daha düşük olduğu (şişe başına yaklaşık 18 milyon VND) ve Keytruda'nın 55-65 milyon VND olduğu düşünüldüğünde, kanser hastalarının tedaviye erişimini artırması bekleniyor. Ancak, bu iki ilaç da henüz sağlık sigortası kapsamında değil.
Pembrolizumab, T bağışıklık hücrelerine "hızlı salınım" yoluyla etki eder. Normalde, kanser hücreleri T hücrelerinin saldırmasını engelleyen bir "dur" sinyali gönderir. İlaç bu sinyali engelleyerek, akciğer, böbrek, rahim ağzı ve melanom gibi birçok kanser türünde etkili olan tümörleri yok etme yeteneğini yeniden etkinleştirir.
İlaç Dairesi'ne göre, ilaç dolaşım ruhsatı dosyasının tamamı işletme tarafından yönetmeliklere uygun olarak sunulmuştur. 2024 yılına kadar bu ilaç klinik çalışmalarını tamamlamıştır. Ancak işletme, bu ürün gibi biyobenzer ilaçlar için zorunlu bir gereklilik olan ve yeni bir klinik çalışma olmayan bir immünojenisite değerlendirmesi yapmaya devam etmiştir.
İşletmeler, dolaşım sürecinde ilacın güvenliği, etkinliği ve immünojenitesini izlemek ve yönetim kuruluşunun isteği doğrultusunda 3 veya 5 yıl sonra periyodik olarak raporlamakla yükümlüdür.
Daha önce, aktif bileşen Pembrolizumab içeren birçok ilaç ülkede dolaşıma sunulmak üzere ruhsatlandırılmıştı. İlaç Dairesi'nin 31 Ekim tarihli 628/QD-QLD sayılı kararıyla, üretim tarihinden itibaren 24 ay son kullanma tarihine sahip Pembroria (100 mg/4 ml) konsantre infüzyon solüsyonu da dahil olmak üzere 14 aşı ve biyolojik ürün onaylanmıştı.
Source: https://baolangson.vn/thuoc-ung-thu-pembroria-cua-nga-vua-duoc-cap-phep-tai-viet-nam-co-gia-bao-nhieu-5064810.html







![[Fotoğraf] Genel Sekreter To Lam, Long Thanh Uluslararası Havalimanı Projesi'ni ziyaret etti](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1763008564398_vna-potal-tong-bi-thu-to-lam-tham-du-an-cang-hang-khong-quoc-te-long-thanh-8404600-1261-jpg.webp)




















































































![Dong Nai OCOP geçişi: [Madde 3] Turizmin OCOP ürün tüketimiyle ilişkilendirilmesi](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Yorum (0)