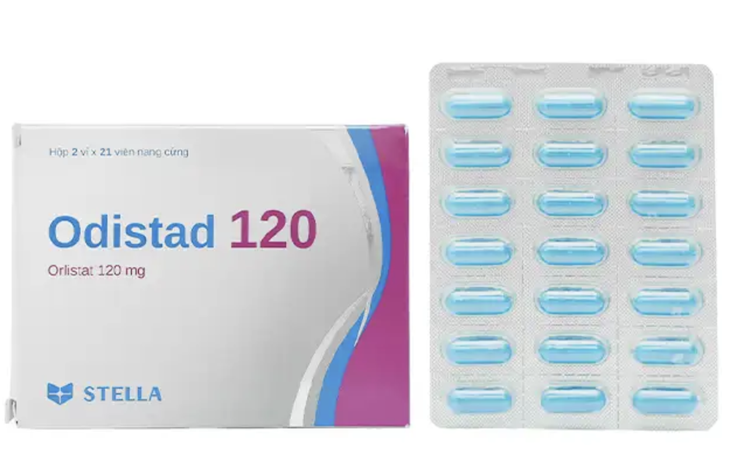
Odistad 120 Gewichtsverlustpillen, Hartkapseln, hergestellt von Stellapharm Joint Venture Company Limited
Die vietnamesische Arzneimittelbehörde hat gerade beschlossen, die Zulassungsbescheinigungen für den Arzneimittelverkehr in Vietnam für drei Medikamente zu widerrufen.
Insbesondere wird das Medikament Tadalafil 20 mg in Tablettenform von der Meyer-BPC Joint Venture Company mit Sitz in 6A3, National Highway 60, Phu Tan Ward, Ben Tre City, Provinz Ben Tre, Registrierungsnummer 893110457024 (alte Registrierungsnummer: VD-31364-18) hergestellt.
Odistad 120 , Hartkapsel, hergestellt von Stellapharm Joint Venture Company Limited – Niederlassung 1, 40 Tu Do Avenue, Vietnam – Singapore Industrial Park, An Phu Ward, Thuan An Town, Provinz Binh Duong . Das Arzneimittel hat die Registrierungsnummer 893100515124 (alte Registrierungsnummer: VD-21535-14).
Arzneimittel Vacobufen 400 , Tabletten, hergestellt von der Vacopharm Pharmaceutical Joint Stock Company, km 1954, National Highway 1A, Tan Khanh Ward, Tan An City, Provinz Long An , Registrierungsnummer 893100032324.
Die vietnamesische Arzneimittelbehörde erklärte, dass vor dem 3. Juni hergestellte Arzneimittel bis zu ihrem Verfallsdatum in Verkehr gebracht werden dürfen. Die für die Arzneimittelregistrierung und -herstellung zuständigen Einrichtungen müssen für die Überwachung und Verantwortung der Qualität, Sicherheit und Wirksamkeit der Arzneimittel während des Umlaufs verantwortlich sein.
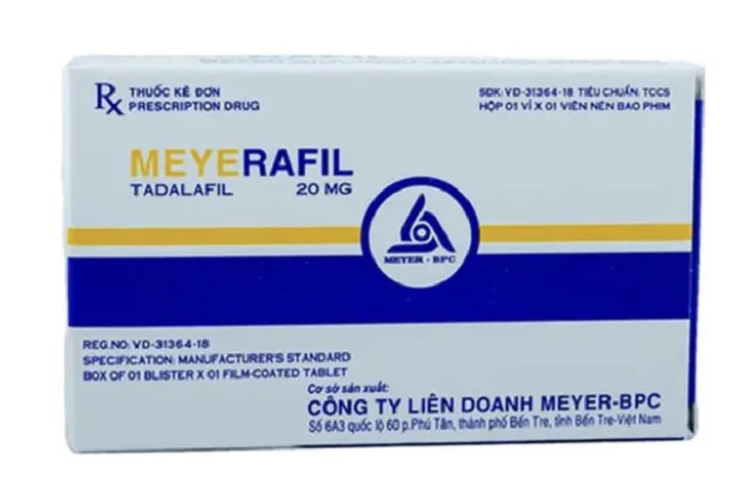
Tadalafil 20 mg, Tablettenform, hergestellt bei der Meyer-BPC Joint Venture Company
Tadalafil 20 mg ist ein Medikament zur Behandlung von Erektionsstörungen bei Männern. Odistad 120 ist ein Medikament zur Behandlung von Fettleibigkeit und zur Vorbeugung von Gewichtszunahme bei Erwachsenen. Vacobufen 400 ist ein Medikament zur Linderung von Menstruationsbeschwerden, Zahnschmerzen und zur vorübergehenden Fiebersenkung.
Als Grund für den Widerruf gab die Behörde an, dass die Arzneimittelregistrierungsstelle freiwillig die Aufhebung der Registrierungsbescheinigung für den Arzneimittelverkehr in Vietnam beantragt habe.
Laut Herrn Ta Manh Hung, stellvertretender Direktor der Arzneimittelbehörde, ist es für Unternehmen normal, ihre Registrierungsnummer freiwillig zurückzuziehen, wenn für sie kein Bedarf mehr besteht, Produkte herzustellen und auf den Markt zu bringen.
Er sagte jedoch auch, dass in letzter Zeit mehr Unternehmen freiwillig darum gebeten hätten, ihre Nummern zurückzuziehen.
Quelle: https://tuoitre.vn/thu-hoi-giay-dang-ky-luu-hanh-3-loai-thuoc-giam-dau-tri-roi-loan-cuong-duong-beo-phi-20250604123205584.htm


























![[Foto] Präsident Luong Cuong arbeitet mit den Parteikomitees der Provinzen Hung Yen und Thai Binh an der Umsetzung der Resolution der 11. Zentralkonferenz, 13. Amtszeit](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/6/6/127b735d2761484d81dcee0d7725a25b)
![[Foto] Generalsekretär To Lam empfängt den koreanischen Botschafter in Vietnam](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/6/6/a0765b7543784cbcbfe4755b67d43ab4)
























































![[OCOP REVIEW] Tu Duyen Sirup - Die Essenz von Kräutern aus den Bergen und Wäldern von Nhu Thanh](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/6/5/58ca32fce4ec44039e444fbfae7e75ec)











Kommentar (0)