Laut der vietnamesischen Arzneimittelbehörde (Gesundheitsministerium) wird Femancia von der Me Di Sun Pharmaceutical Joint Stock Company (An Loi Quarter, Hoa Loi Ward, Ben Cat Town, Provinz Binh Duong (alt), jetzt An Loi Street, Hoa Loi Ward, Ho-Chi-Minh-Stadt) hergestellt.
In letzter Zeit wird Femancia von vielen medizinischen Einrichtungen zur Behandlung von Patienten mit Anämie aufgrund von Eisenmangel oder Folsäuremangel verschrieben und ist in vielen Apotheken im ganzen Land erhältlich.
Dieses Medikament ist nicht nur bei Eisenmangelanämie angezeigt, sondern wird auch zur Vorbeugung von Anämie bei Personen mit erhöhtem Eisen- und Folsäurebedarf eingesetzt, z. B. bei schwangeren Frauen, stillenden Frauen, Personen, die sich gerade einer Operation unterzogen haben, und Personen mit schweren Erkrankungen, die sich in der Genesungsphase befinden.
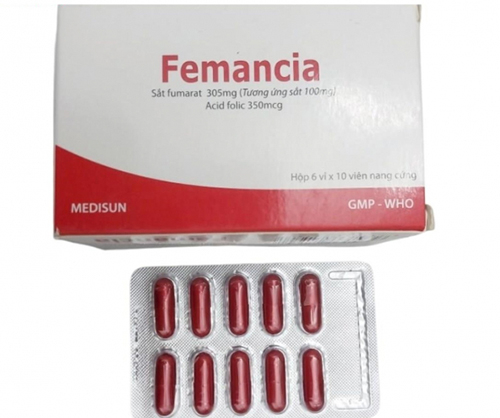
Durch Inspektionen und Tests stellten die Behörden jedoch fest, dass die Charge des Arzneimittels Femancia, Registrierungsnummer VD-27929-17, Darreichungsform, Hartkapsel, elementares Eisen (in Form von Eisenfumarat 305 mg) 100 mg, Folsäure 350 mcg, gegen Stufe 2 verstieß.
Um die Sicherheit der Anwender zu gewährleisten, hat die vietnamesische Arzneimittelbehörde ( Gesundheitsministerium ) einen obligatorischen Rückruf dieser Medikamentencharge an alle Unternehmen, medizinischen Einrichtungen und Anwender angekündigt.
Gemäß dem Rundschreiben 11/2018/TT-BYT des Gesundheitsministers zur Regelung der Qualität von Arzneimitteln und Arzneimittelbestandteilen handelt es sich bei Arzneimitteln der Stufe 2 um Arzneimittel, bei denen es Hinweise darauf gibt, dass sie keine vollständige Wirksamkeit der Behandlung gewährleisten oder ein Risiko darstellen, dass sie für die Anwender unsicher sind, jedoch nicht in einem Ausmaß, dass sie ernsthafte Gesundheitsschäden verursachen oder das Leben des Anwenders beeinträchtigen.
Die vietnamesische Arzneimittelbehörde verlangt von Einrichtungen, die mit Arzneimitteln handeln und diese verwenden, sowie von Einrichtungen für medizinische Untersuchungen und Behandlungen, dass sie Femancia nicht handeln, liefern, abgeben oder verwenden und alle in den Einrichtungen verbleibenden Arzneimittel unter Quarantäne stellen und die Arzneimittel gemäß den Vorschriften an die Liefereinrichtungen zurückgeben.
Das Gesundheitsamt der Stadt Ho Chi Minh inspiziert und beaufsichtigt die Me Di Sun Pharmaceutical Joint Stock Company hinsichtlich des Rückrufs und der Handhabung des oben genannten zurückgerufenen Medikaments Femancia gemäß den Vorschriften. Gleichzeitig wird die Wirksamkeit des Medikamentenrückrufs bewertet (ist der Rückruf gründlich, ist es wahrscheinlich, dass das Produkt weiterhin in Umlauf gebracht und verwendet wird und besteht das Risiko, dass es die Gesundheit der Anwender beeinträchtigt oder nicht).
Zusätzlich zur Rücknahme der Registrierung des Medikaments von der Liste der Medikamente, denen eine Registrierungsbescheinigung für den Vertrieb in Vietnam erteilt wurde, teilte die vietnamesische Arzneimittelbehörde mit, dass Femanica ab dem 16. Juli nicht mehr hergestellt und auf dem Markt vertrieben werde.
Im Kampf gegen Produktfälschungen im medizinischen Bereich wurden in jüngster Zeit zahlreiche Arzneimittel entdeckt, deren Qualität nicht den Anforderungen entspricht, darunter auch gefälschte Arzneimittel. Nach Angaben der vietnamesischen Arzneimittelbehörde inspizierte die Behörde im Juni 38 Einrichtungen. In 17 von ihnen wurden Verstöße festgestellt, darunter Verstöße gegen GMP-Grundsätze, Arzneimittelqualität und Lagerbedingungen.
Das Ministerium hat Entscheidungen getroffen, mit denen die Produktion vorübergehend eingestellt, die Vernichtung minderwertiger Medikamentenchargen verlangt und Rückrufaktionen durchgeführt werden und von einer Reihe von Unternehmen die Entgegennahme von Anträgen vorübergehend gestoppt wird.
Quelle: https://cand.com.vn/y-te/vi-sao-thuoc-dieu-tri-thieu-mau-femancia-bi-cam-san-xuat-luu-hanh--i775163/





























































































![[Infografik] Im Jahr 2025 werden 47 Produkte das nationale OCOP erreichen](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/7/16/5d672398b0744db3ab920e05db8e5b7d)





Kommentar (0)