ภายใต้คำแนะนำใหม่ Leqembi จะถูกกำหนดให้เฉพาะกับผู้ป่วยโรคอัลไซเมอร์ระยะเริ่มต้นที่มียีน ApoE4 ซึ่งเป็นปัจจัยเสี่ยงสำคัญของโรคอัลไซเมอร์เท่านั้น
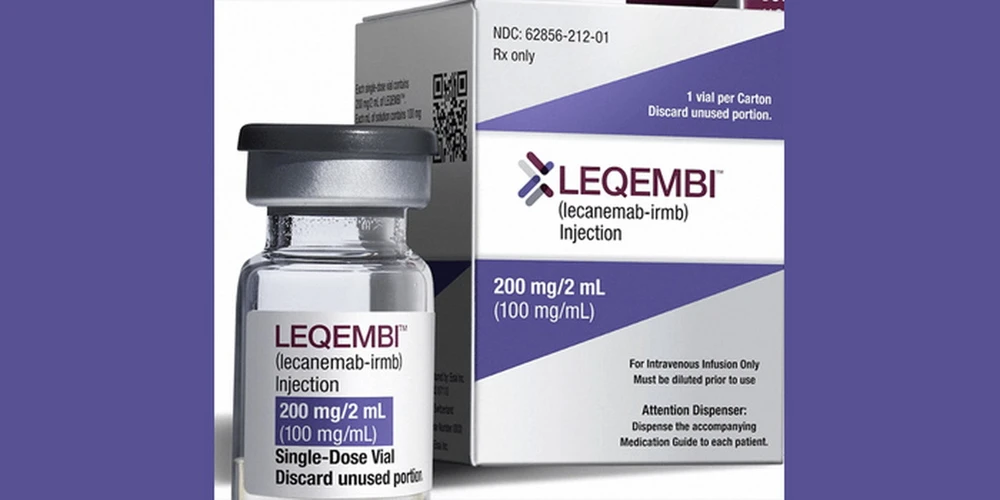
เมื่อวันที่ 14 พฤศจิกายน องค์การยาแห่งยุโรป (EMA) ได้มีมติอนุมัติใบอนุญาตให้ Leqembi ใช้รักษาโรคอัลไซเมอร์ระยะเริ่มต้นอย่างเป็นทางการ การตัดสินใจครั้งนี้ถือเป็นก้าวสำคัญในการต่อสู้กับโรคทางระบบประสาทเสื่อมชนิดนี้
ก่อนหน้านี้ EMA เคยปฏิเสธ Leqembi ในเดือนกรกฎาคม เนื่องจากกังวลเกี่ยวกับผลข้างเคียงร้ายแรง เช่น ภาวะสมองบวม อย่างไรก็ตาม หลังจากการประเมินอย่างละเอียดถี่ถ้วนมากขึ้น คณะกรรมการผลิตภัณฑ์ยาสำหรับมนุษย์ (CHMP) ของ EMA ได้กลับคำตัดสิน
ภายใต้คำแนะนำใหม่ Leqembi จะถูกกำหนดให้เฉพาะกับผู้ป่วยโรคอัลไซเมอร์ระยะเริ่มต้นที่มียีน ApoE4 ซึ่งเป็นปัจจัยเสี่ยงสำคัญของโรคอัลไซเมอร์เท่านั้น
การศึกษาแสดงให้เห็นว่าในกลุ่มผู้ป่วยเหล่านี้ ประโยชน์ของ Leqembi ในการชะลอความก้าวหน้าของโรคมีมากกว่าความเสี่ยง
คณะกรรมาธิการยุโรปจะเป็นผู้ตัดสินใจขั้นสุดท้ายว่าจะให้อนุญาตทางการตลาดสำหรับยา Leqembi ทั่วสหภาพยุโรปหรือไม่ เมื่อได้รับการอนุมัติแล้ว แต่ละประเทศสมาชิกจะเป็นผู้กำหนดราคาและความคุ้มครองประกัน สุขภาพ สำหรับยาของตนเอง
Leqembi เป็นผลิตภัณฑ์ที่พัฒนาและผลิตโดยบริษัทเภสัชกรรมชั้นนำสองแห่ง ได้แก่ Eisai (ประเทศญี่ปุ่น) และ Biogen (ประเทศสหรัฐอเมริกา) ยานี้ออกฤทธิ์โดยการกำจัดคราบโปรตีนเบตาอะไมลอยด์ ซึ่งเป็นโปรตีนพิษที่สะสมอยู่ในสมองของผู้ป่วยโรคอัลไซเมอร์
ที่มา: https://www.vietnamplus.vn/eu-bat-den-xanh-cho-viec-su-dung-thuoc-leqembi-dieu-tri-alzheimer-post993619.vnp
































































































การแสดงความคิดเห็น (0)