Vietnamský úřad pro léčiva a Ministerstvo zdravotnictví právě oznámil rozhodnutí o udělení osvědčení o registraci k oběhu a prodloužení platnosti osvědčení o registraci k oběhu pro 355 léků vyráběných i dovážených v tuzemsku.
 |
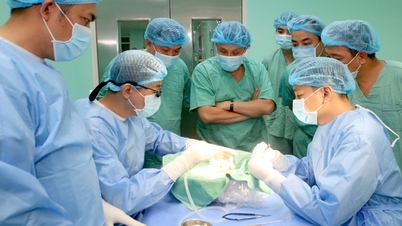
Ministerstvo zdravotnictví právě vydalo nová a obnovená registrační osvědčení pro 355 druhů léčiv. (Ilustrační foto) |
Ředitel Vietnamského úřadu pro léčiva Ministerstva zdravotnictví Dr. Vu Tuan Cuong podepsal 4 po sobě jdoucí rozhodnutí o prodloužení a opětovném vydání osvědčení o registraci léčiv domácí i zahraniční výroby. V souladu s tím byla prodloužena a znovu vydána 355 druhů léčiv, z nichž některé jsou nově vydány a prodlouženy na 3 roky, jiné na 5 let v závislosti na konkrétních podmínkách.
Léky, které byly tentokrát obnoveny a znovu vydány, jsou z hlediska farmakologických účinků poměrně rozmanité a zahrnují léky na léčbu rakoviny, kardiovaskulárních onemocnění, cukrovky, antivirotika a další běžná antipyretika, analgetika a protizánětlivé léky...
Vietnamský úřad pro kontrolu léčiv (Drug Administration) vyžaduje, aby zařízení vyrábějící a registrující léčiva byla odpovědná za výrobu léčiv v souladu se záznamy a dokumenty registrovanými u Ministerstva zdravotnictví a aby na etiketě léčiva uváděla registrační číslo vydané vietnamským ministerstvem zdravotnictví.
Léčiva podléhající zvláštní kontrole mohou být vyráběna a uváděna do oběhu pouze s osvědčením o způsobilosti k farmaceutické činnosti. Předmět činnosti v oblasti léčiv podléhajících zvláštní kontrole je vhodný pro rozsah provozu zařízení a splňuje ustanovení článku 143 odstavce 5 nařízení vlády č. 54/2017/ND-CP, které podrobně stanoví řadu článků a opatření k provedení zákona o lékárenství.
Zároveň aktualizovat standardy kvality léčiv dle ustanovení oběžníku ministra zdravotnictví č. 11/2018/TT-BYT, kterým se upravuje jakost léčiv a farmaceutických složek, a oběžníku ministra zdravotnictví č. 03/2020/TT-BYT, kterým se mění a doplňuje řada článků oběžníku č. 11/2018/TT-BYT, kterým se upravuje jakost léčiv a farmaceutických složek.
Implementovat a koordinovat s dovozním zařízením dodržování ustanovení oficiálního výměru č. 5853/QLD-CL ze dne 19. dubna 2019 Ministerstva pro správu léčiv o kontrole kvality surovin pro výrobu sartanových léčiv v případě léčiv uvedených v článku 1 vydaných s tímto rozhodnutím obsahujících farmaceutické složky ze skupiny sartanů.
Aktualizovat označení léčiv a pokyny k použití v souladu s ustanoveními oběžníku ministra zdravotnictví č. 01/2018/TT-BYT, kterým se upravují označení léčiv, složky léčiv a pokyny k použití v léčivých přípravcích, do 6 měsíců ode dne podpisu a vyhlášení tohoto rozhodnutí, a to formou změny a doplnění osvědčení o registraci léčivého přípravku předepsaných v oběžníku č. 08/2022/TT-BYT.
Kromě toho musí výrobní a obchodní zařízení koordinovat s léčebnými zařízeními dodržování platných předpisů týkajících se léků na předpis, monitorovat bezpečnost, účinnost a nežádoucí účinky léků na vietnamské obyvatelstvo a syntetizovat a podávat zprávy v souladu s předpisy...
Zařízení pro registraci léčiv musí zajistit, aby si po dobu platnosti osvědčení o registraci léčiva a léčivých látek zachovalo své provozní podmínky. V případě, že registrační zařízení již nesplňuje provozní podmínky, musí být odpovědné za změnu registračního zařízení v souladu s oběžníkem č. 08/2022/TT-BYT do 30 dnů ode dne, kdy registrační zařízení přestalo splňovat provozní podmínky.
Úřad pro kontrolu léčiv (DSA) v minulosti opakovaně vydával nová a prodloužená osvědčení o registraci léčiv s platností 3 nebo 5 let v souladu s ustanoveními zákona o lékárnách z roku 2016 pro mnoho farmaceutických produktů, aby uspokojil potřeby lidí v oblasti lékařského vyšetření, léčby a prevence nemocí.
Podle ministerstva zdravotnictví v současnosti existuje asi 22 000 registračních čísel léčiv s oběhovými vízy s přibližně 800 účinnými látkami různých typů.
Zdroj




![[Fotografie] Generální tajemník Lama a předseda Národního shromáždění Tran Thanh Man se zúčastnili 80. výročí tradičního Dne vietnamského inspekčního sektoru](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/17/1763356362984_a2-bnd-7940-3561-jpg.webp)



































































































Komentář (0)