Die Arzneimittelbehörde Vietnams ( Gesundheitsministerium ) hat die Zulassung für den Vertrieb des in Russland hergestellten Medikaments Pembroria zur Krebsbehandlung offiziell erteilt.
Professor Le Van Quang, Direktor des K-Krankenhauses (Hanoi), erklärte, dass die Klinik das Medikament bald zur Behandlung von Patienten einsetzen werde. Laut seinen Angaben wird Pembroria derzeit noch nicht von den Krankenkassen übernommen.
Das Medikament Pembroria, hergestellt von der russischen Firma PK-137, kostet derzeit etwa 18 Millionen VND pro Flasche. Patienten benötigen üblicherweise zwei Flaschen für einen Behandlungszyklus. Dieser dauert 12 bis 24 Zyklen, bis keine Wirkung mehr eintritt. Die Behandlung wird dann beendet. Die Patienten werden einmal monatlich behandelt.
Laut Dr. Nguyen Hong Vu, der früher am City of Hope Research Institute in Kalifornien, USA, tätig war, handelt es sich bei Pembroria um ein Krebsmedikament mit dem Wirkstoff Pembrolizumab (100 mg/4 ml), das von der Limited Liability Company „PK‑137“ hergestellt wird.
Der Wirkstoff Pembrolizumab, der auch im bekannten Präparat Keytruda enthalten ist, ist ein humanisierter monoklonaler Antikörper, der gegen PD-1 gerichtet ist. PD-1 ist ein Mechanismus, der das Immunsystem des Patienten aktiviert und so zur Bekämpfung von Krebszellen anregt. Das Medikament wurde mithilfe von Mäusen entwickelt, die menschliche Gene zur Antikörperproduktion trugen, und anschließend industriell auf der CHO-Zelllinie hergestellt.
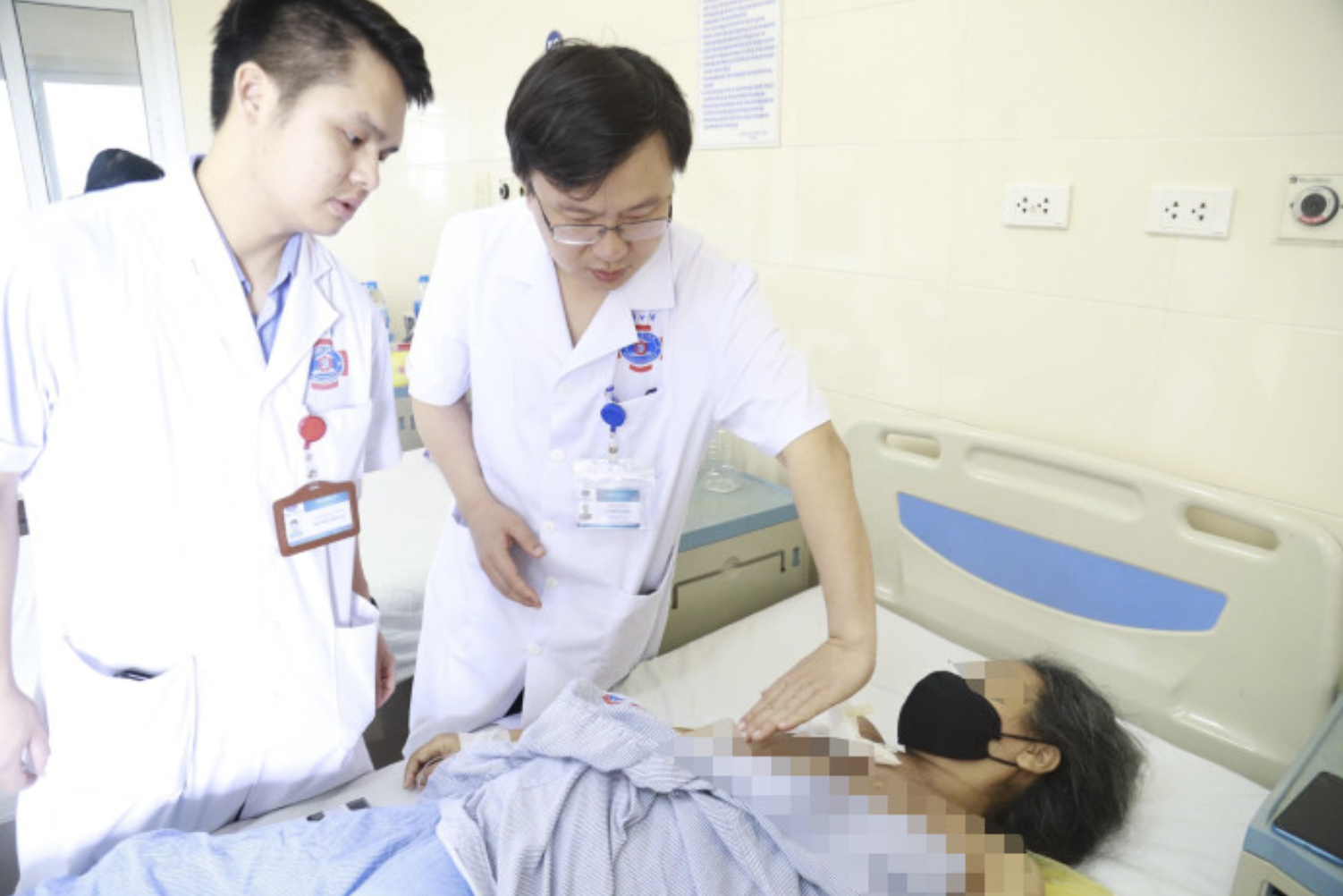
Krebspatienten werden im K-Krankenhaus behandelt. Foto: Manh Tran.
Keytruda wurde präklinischen und klinischen Studien der Phasen I, II und III unterzogen und wurde 2014 von der US-amerikanischen Arzneimittelbehörde FDA erstmals zur Behandlung des malignen Melanoms zugelassen. Seitdem wurde das Anwendungsgebiet auf mehr als 15 weitere Krebsindikationen ausgeweitet.
Bezüglich Pembroria sagte Dr. Vu, dass es nicht genügend international veröffentlichte klinische Daten gebe, um die vollständige Gleichwertigkeit von Pembroria mit Keytruda zu bestätigen.
In der jüngsten Entscheidung verlangt die vietnamesische Arzneimittelbehörde, dass Arzneimittelhersteller nach Erteilung einer Zulassungsbescheinigung für den Arzneimittelverkehr alle drei Monate über den Fortschritt der klinischen Phase-III-Studie zur Immunogenitätsüberwachung berichten und nach Abschluss des Forschungszeitraums Dokumente zur Änderung und Aktualisierung der Daten zur Immunogenitätsüberwachung in Phase III einreichen müssen.
Laut Angaben der Arzneimittelzulassungsbehörde hat Pembrolizumab mehr als 14 Indikationen für verschiedene Krebsarten (wie Lungenkarzinom, Melanom, Darmkrebs, Gebärmutterhalskrebs, Nierenzellkarzinom, Brustkrebs...).
Vietnamnet.vn
Quelle: https://vietnamnet.vn/benh-vien-k-noi-ve-viec-dua-thuoc-chua-ung-thu-cua-nga-vao-dieu-tri-2462018.html







![[Foto] Die „Narben“ der Berge und Wälder von Da Nang nach Stürmen und Überschwemmungen](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1762996564834_sl8-jpg.webp)



























![[Foto] Premierminister Pham Minh Chinh nimmt an einer Konferenz zur Überprüfung des einjährigen Einsatzes von Streitkräften zur Gewährleistung von Sicherheit und Ordnung auf lokaler Ebene teil.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762957553775_dsc-2379-jpg.webp)



























































![Dong Nai OCOP-Übergang: [Artikel 3] Verknüpfung von Tourismus und OCOP-Produktkonsum](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Kommentar (0)