در سالهای اخیر، تغییر عمدهای در درک ما از سرطان، درک این موضوع بوده است که میکروارگانیسمها نه تنها در روده، بلکه در بافت تومور - از جمله تومورهای جامد مانند سینه، پروستات و ریه - نیز ساکن هستند. این جوامع میکروبی (که در مجموع میکروبیوم درون توموری یا میکروبیوم مرتبط با تومور نامیده میشوند) مستقیماً با سلولهای سرطانی، سلولهای ایمنی و محیط اطراف تعامل دارند و از این طریق بر زیستشناسی تومور، پاسخ به درمان و پیشآگهی تأثیر میگذارند.
آیا میکروبیوتای موجود در بافت تومور با میکروبیوتای روده متفاوت است؟
پیش از این تصور میشد که بافت تومور یک «منطقه استریل» است، اما تجزیه و تحلیل ژنومی و توالییابی اخیر، DNA/RNA میکروبی را در بسیاری از نمونههای تومور برداشته شده نشان داده است. این میکروبها ممکن است درون سلولهای سرطانی، درون سلولهای ایمنی یا در بافت همبند اطراف قرار داشته باشند. ترکیب و تراکم میکروبها بین انواع تومور و بیماران متفاوت است - به عنوان مثال، تومورهای پستان در مقایسه با برخی تومورهای دیگر، تنوع میکروبی نسبتاً بالایی دارند - و محل قرارگیری آنها (درون سلولی در مقابل خارج سلولی) تعیین میکند که چگونه بر بافت بیمار تأثیر میگذارند.
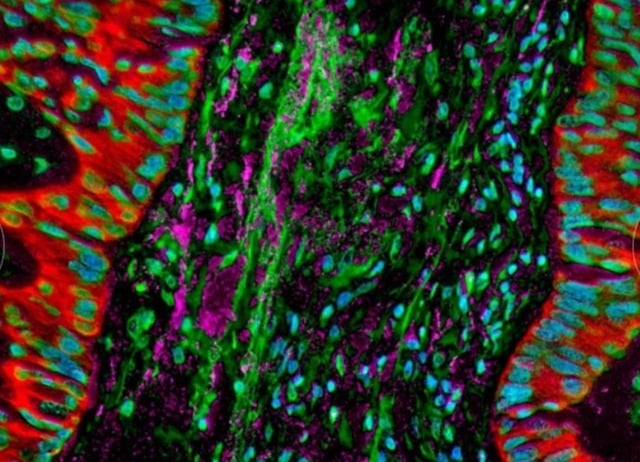
تصاویر میکروسکوپی نشان میدهند که باکتریهایی که در سلولهای سرطانی ریه ساکن هستند، پاسخ ایمنی بدن را تغییر میدهند.
نقش باکتریها و ویروسها در بافت سینه، پروستات و ریه
میکروبیوتای محلی میتوانند محیط ایمنی را به صورت سرکوبکننده یا فعالکننده تعدیل کنند. برخی از میکروبها سیگنالهای التهابی مزمن را تحریک میکنند (مثلاً از طریق گیرندههای تشخیص الگو مانند TLRها) که منجر به افزایش سیتوکینهای پیشالتهابی میشود که سلولهای ایمنی سرکوبکننده (ماکروفاژهای M2، Tregs) را جذب میکنند - در نتیجه به تومورها کمک میکنند تا از سیستم ایمنی فرار کنند. برعکس، برخی از باکتریها یا ویروسها میتوانند ایمنی سلولی را تحریک کنند (افزایش ارائه آنتیژن، فعالسازی سلولهای T CD8+) و به اثربخشی ایمونوتراپی کمک کنند. بنابراین، میکروبیوتای یکسان بسته به زمینه میتواند "دوست" یا "دشمن" باشد.
برخی از باکتریها سموم یا ترکیباتی تولید میکنند که به DNA آسیب میرسانند و باعث جهش و پیشرفت سرطان میشوند. برعکس، سایر میکروبها میتوانند متابولیسمی را القا کنند که رشد سلولهای تومور را کاهش میدهد. در بافت سینه، مطالعات وجود باکتریهای دخیل در مسیرهای التهابی و متابولیکی را اثبات کردهاند؛ در پروستات، تغییرات میکروبی با پیشرفت بیماری و پاسخ به درمان ضد آندروژن مرتبط است؛ و در ریه، میکروبیوم درونزا ممکن است با التهاب ناشی از سیگار کشیدن تعامل داشته باشد و ریزمحیط را تغییر دهد تا تومورها کمتر به ایمونوتراپی پاسخ دهند.
وجود یا ترکیب میکروبیوم داخل توموری میتواند اثربخشی شیمیدرمانی، پرتودرمانی و بهویژه ایمونوتراپی را تغییر دهد. مکانیسمها شامل تغییرات ریزمحیط (pH، تغذیه)، غیرفعالسازی موضعی دارو (برخی از باکتریها دارای آنزیمهای تجزیهکننده دارو هستند) یا تعدیل ارائه آنتیژن و نفوذ سلولهای ایمنی است. مطالعات متعددی نشان دادهاند که تفاوت در میکروبیوتای تومور با پاسخ یا مقاومت در برابر مهارکنندههای ایست بازرسی ایمنی (ICI) مرتبط است.
اصلاح میکروبیوم موضعی در بافت تومور - استراتژیهای موجود و تحقیقاتی
ایده دخالت مستقیم در میکروبیوم تومور، راههای درمانی جدیدی را باز میکند. برخی از رویکردهایی که تاکنون توسعه یافتهاند یا در حال توسعه هستند عبارتند از:
در برخی مدلهای تجربی، استفاده از آنتیبیوتیکها برای از بین بردن گونههای «بد» در تومورها، پاسخ بافتها به داروها را تغییر داده است. با این حال، آنتیبیوتیکهای سیستمیک اثرات گستردهای دارند (و ممکن است میکروبیوم روده را که برای ایمنی ضروری است، مختل کنند)، بنابراین استفاده موضعی از آنتیبیوتیک یا توسعه آنتیبیوتیکهای انتخابی برای گونههای هدف در اولویت است.
ایده این است که باکتریهای مهندسیشدهای را به بافت تومور وارد کنیم که سیتوکینهای محرک سیستم ایمنی، آنزیمهای متابولیکی که pH را تغییر میدهند یا آنزیمهایی که سرکوبکنندههای سیستم ایمنی را تجزیه میکنند، ترشح کنند. برخی از آزمایشهای پیشبالینی با استفاده از باکتریهای ضعیفشده برای رساندن داروها به صورت موضعی، نویدبخش بودهاند.
ویروسهای انکولیتیک برای از بین بردن مستقیم سلولهای سرطانی و همزمان تحریک ایمنی ضد تومور مورد مطالعه قرار گرفتهاند. ترکیب ویروسهای انکولیتیک با ویرایش میکروبیوم میتواند فعالسازی سلولهای T موضعی را افزایش داده و پاسخهای سیستمیک را گسترش دهد.
اگرچه موضوع اینجا میکروبیولوژی موضعی است، اما توجه به این نکته مهم است که یک محور روده-تومور وجود دارد: تغییرات در میکروبیوم روده (مثلاً از طریق رژیم غذایی، پروبیوتیکها، FMT) میتواند به طور غیرمستقیم میکروبیوم داخل توموری و ایمنی سیستمیک را تغییر دهد و از این طریق بر بافت تومور در ریه، پستان یا پروستات تأثیر بگذارد.

دانشمندان در حال تجزیه و تحلیل DNA میکروبی در بافت تومور هستند تا گونههایی را پیدا کنند که بر اثربخشی درمان سرطان تأثیر میگذارند.
چالشها و ملاحظات بالینی
- تمایز بین «علت» و «معلول»: بسیاری از مطالعات فعلی هنوز همبستگیها را توصیف میکنند اما رابطه علّی بین میکروبیولوژی و پیشرفت تومور را تأیید نکردهاند.
- استانداردسازی فنی: نمونهبرداری، جداسازی DNA/RNA، جلوگیری از آلودگی خارجی و تجزیه و تحلیل بیوانفورماتیک، همگی برای دستیابی به نتایج قابل اعتماد، نیاز به استانداردسازی دارند.
- تنوع زیاد بین بیماران: میکروبیوم وابسته به فرد است؛ مداخلات باید فردی باشند.
- ایمنی: وارد کردن باکتریها یا ویروسهای زنده به بافت تومور، خطر عفونت یا واکنش بیش از حد سیستم ایمنی را به همراه دارد؛ این روشهای درمانی نیاز به آزمایشهای دقیق دارند.
مطالعه میکروبیوم مرتبط با تومور، لایه جدیدی از زیستشناسی را در انکولوژی میگشاید: میکروبیوم محلی میتواند هم یک عامل پیشبرنده سرطان و هم ابزاری برای تعدیل ایمنی و دارورسانی هدفمند به تومورها باشد. با پیشرفت در توالییابی، بافتشناسی، بیومیمیکری و تکنیکهای مهندسی میکروبیوم، آینده نزدیک نویدبخش این است که استراتژیهای درمانی که میکروبیوم محلی را هدف قرار میدهند یا از آن بهرهبرداری میکنند - از باکتریهای مهندسی زیستی شده، فاژهای انتخابی گرفته تا ویروسهای انکولیتیک دارای سیستم ایمنی - به بخشی از درمان چندوجهی تبدیل خواهند شد.
با این حال، مسیر بالینی هنوز طولانی است؛ استانداردسازی آزمایشها، اثبات علیت و تضمین ایمنی، پیشنیازهای لازم برای پذیرش گسترده این مداخلات خواهند بود.
منبع: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm







































































































نظر (0)