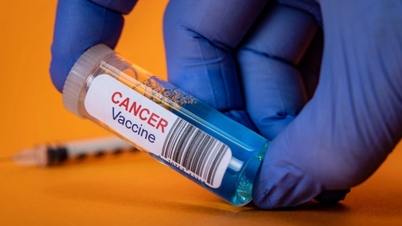
Après que le médicament anticancéreux russe Pembronia a récemment obtenu l'autorisation de mise sur le marché auprès de l'Agence nationale de sécurité du médicament, il a attiré l'attention de nombreuses personnes, notamment des patients atteints de cancer.
Par ailleurs, de nombreux avis divergent quant au fait que ce médicament, actuellement en phase 3 d'essais cliniques, n'est pas encore largement diffusé et que les essais cliniques seront menés au Vietnam dès l'obtention du certificat d'autorisation de mise sur le marché.
Un représentant de l'Agence vietnamienne des médicaments a déclaré que le Pembronia avait achevé ses essais cliniques et obtenu une autorisation de mise sur le marché pour une large distribution au Vietnam. L'obtention de ce certificat d'enregistrement signifie que le Pembronia peut désormais être distribué et utilisé à grande échelle, au même titre que les autres médicaments.

Bien que le médicament réponde aux normes de sécurité et de qualité requises pour sa mise sur le marché, le fabricant continuera de surveiller et d'évaluer son immunogénicité chez la population vietnamienne. Cette surveillance est obligatoire pour les médicaments biosimilaires, car l'immunogénicité peut provoquer une réaction immunitaire chez l'utilisateur.
Durant le processus de mise sur le marché, les entreprises sont responsables du suivi et de la communication périodique, après 3 ou 5 ans, des informations relatives à la sécurité, à l'efficacité et à l'immunogénicité du médicament, conformément aux exigences de l'organisme de gestion.
Pembroria est un biosimilaire, ou « copie », du médicament Keytruda développé par MSD (États-Unis). Les deux contiennent le principe actif pembrolizumab, un anticorps monoclonal qui aide le système immunitaire à reconnaître et à attaquer les cellules cancéreuses. Keytruda a été approuvé pour la première fois aux États-Unis en 2014 et est actuellement l'une des immunothérapies les plus utilisées dans le traitement du cancer au monde .
Selon un représentant de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), il s'agit d'un anticorps monoclonal destiné au traitement du cancer, et non d'un nouveau médicament. Pembroria est un produit biologique similaire au pembrolizumab, produit de référence de MSD Pharmaceuticals (une multinationale pharmaceutique américaine), commercialisé depuis 2017. Toutefois, la disponibilité de davantage de traitements contre le cancer offre également de meilleures perspectives d'accès aux soins pour les patients.
Selon les informations de l'agence d'enregistrement des médicaments, le pembrolizumab compte plus de 14 indications pour différents types de cancer, tels que : le cancer du poumon non à petites cellules, le mélanome, le cancer colorectal, le cancer du col de l'utérus, le carcinome à cellules rénales, le cancer du sein...
De plus, ce médicament est également indiqué dans le traitement des tumeurs présentant des mutations génétiques spécifiques telles que MSI-H, une charge mutationnelle tumorale élevée ou une expression positive de PD-L1. En pratique clinique, le pembrolizumab est souvent utilisé lorsque le cancer a métastasé ou lorsque le patient ne répond pas aux traitements conventionnels comme la chirurgie, la radiothérapie ou la chimiothérapie.
Actuellement, le médicament Pembronia, produit par la société à responsabilité limitée « PK-137 » (Russie), coûte environ 18 millions de VND par flacon. Les patients utilisent généralement deux flacons pour un traitement complet, qui dure de 12 à 24 cycles, jusqu'à ce que le médicament ne soit plus efficace, puis le traitement est interrompu. Une injection est administrée chaque mois. Au Vietnam, le prix du Keytruda est d'environ 55 à 60 millions de VND par flacon.
Pour intégrer la pembroïrie aux traitements, les hôpitaux devront lancer un appel d'offres. Actuellement, la pembroïrie n'est pas prise en charge par l'assurance maladie .
Selon un représentant de l'Administration des médicaments, outre le médicament russe mentionné ci-dessus, le Vietnam compte actuellement 99 types de médicaments anticancéreux ayant reçu une autorisation de mise sur le marché et toujours en vigueur.
Source : https://cand.com.vn/y-te/bo-y-te-noi-gi-ve-thuoc-chua-ung-thu-cua-nga--i787835/


![[Photo] Les « cicatrices » des montagnes et des forêts de Da Nang après les tempêtes et les inondations](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1762996564834_sl8-jpg.webp)


![[Photo] Autoroutes traversant Dong Nai](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)
![[Photo] Le Premier ministre Pham Minh Chinh participe à une conférence pour examiner une année de déploiement des forces pour participer à la protection de la sécurité et de l'ordre au niveau local.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762957553775_dsc-2379-jpg.webp)






















































































![Transition de Dong Nai à l'OCOP : [Article 3] Lier le tourisme à la consommation de produits de l'OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Comment (0)