Neuralink, la société d'implants de puces cérébrales d'Elon Musk, affirme avoir reçu l'approbation de la Food and Drug Administration (FDA) américaine pour son premier essai clinique sur l'homme.

Neuralink, fondée en 2016, a déclaré dans un communiqué qu'il s'agissait de la première étape qui « permettra un jour à notre technologie d'aider de nombreuses personnes ».
« Le recrutement n'a pas encore commencé pour notre essai clinique », a ajouté la société de Musk sur Twitter, promettant plus d'informations dans les prochains jours.
L'entrepreneur milliardaire Elon Musk avait prédit en décembre dernier que Neuralink recevrait l'approbation réglementaire au premier semestre de cette année. Et il avait raison, même si le processus d'approbation n'a pas été simple et a été rejeté l'année dernière.
Neuralink suscite des attentes croissantes pour ses produits depuis plusieurs années. En 2020, Elon Musk a affirmé lors d'une présentation que les puces de l'entreprise seraient capables de guérir des maladies comme la paralysie et l'insomnie. Il a ajouté que les puces Neuralink pourraient même conférer aux utilisateurs une vision « surhumaine ». À l'époque, l'entreprise avait fait la démonstration de ses premiers implants de puces cérébrales sur des porcs.

En 2021, les représentants de Neuralink ont donné l'une de leurs présentations les plus virales à ce jour. Un singe nommé Pager était assis devant un téléviseur et observait attentivement ce qui se passait à l'écran : un jeu vidéo appelé Pong. Le primate contrôlait ses mouvements avec ses seuls yeux, grâce à un dispositif semi-conducteur de la taille d'une pièce de 25 cents implanté dans les deux hémisphères de son cerveau.
Depuis 2019, Elon Musk s'est vanté à plusieurs reprises de solliciter l'approbation de la FDA pour des essais cliniques sur l'homme. Mais les dirigeants de l'entreprise ne déposeront pas de demande auprès de l'autorité de réglementation avant 2022. Selon Reuters, la première demande de Neuralink a été rejetée par la FDA peu après son dépôt. L'agence aurait exprimé des inquiétudes concernant « la batterie au lithium de l'appareil, le risque de migration des fils de l'implant dans le cerveau et la difficulté de retirer l'appareil en toute sécurité sans endommager les tissus cérébraux ».
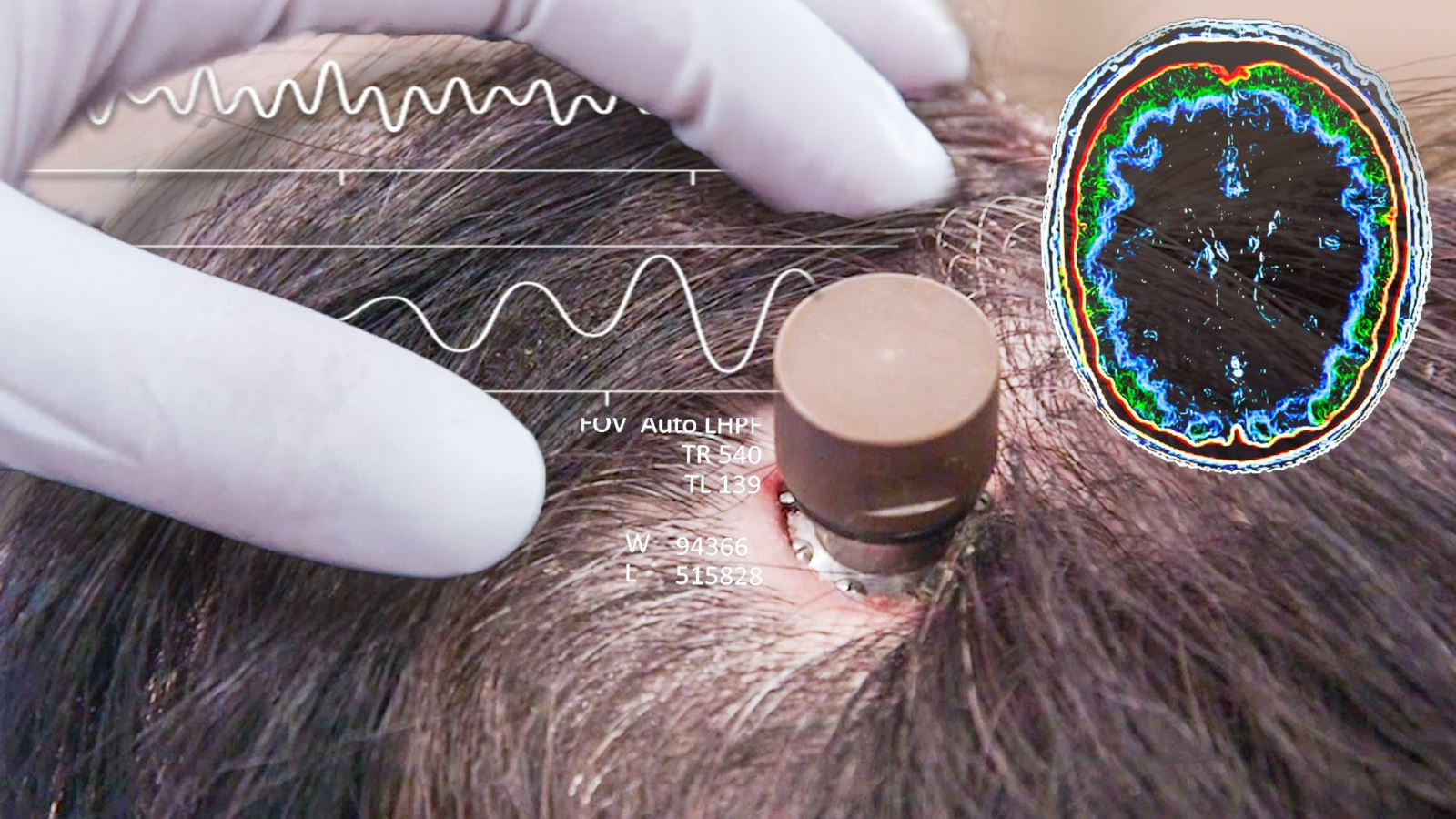
Selon un rapport spécial de Reuters de mars, certains employés de Neuralink ont exprimé des doutes quant à la capacité de Neuralink à surmonter rapidement les problèmes soulevés par la FDA. Kip Ludwig, ancien directeur du programme d'ingénierie neuronale aux National Institutes of Health (NIH) des États-Unis, a déclaré à Reuters que « Neuralink ne semble pas avoir l'état d'esprit et l'expérience nécessaires pour commercialiser rapidement ce produit ».
Neuralink n'est pas la seule entreprise à se préparer à mener des essais cliniques d'implants cérébraux sur l'homme. L'un de ses principaux concurrents, Paradromics, sollicite également l'approbation de la FDA.
Fondée en 2015, la start-up de neurotechnologie basée à Austin, au Texas, a réalisé d'énormes progrès avec son dispositif implantable. Son produit, baptisé Connexus Direct Data, est décrit comme un dispositif de communication pouvant aider les patients ayant perdu l'usage de la parole ou de la saisie. La technologie est si prometteuse que la FDA a attribué à Paradromics la désignation de « Dispositif révolutionnaire », un programme qui permet à 32 demandes d'autorisation de mise sur le marché d'être approuvées rapidement, car elles pourraient bénéficier aux patients dans leur traitement et leur diagnostic.
Synchron est une autre entreprise qui entre dans le secteur naissant des interfaces cerveau-ordinateur (BCI).
Ces entreprises proposent des semi-conducteurs de tailles, de poids et de performances variés, ainsi que des méthodes chirurgicales pour les implanter dans le cerveau humain. Mais elles sont toutes aussi optimistes quant aux bénéfices futurs qu'ils pourraient apporter à des millions de personnes.
Selon baotintuc.vn
Lien source





































































































Comment (0)