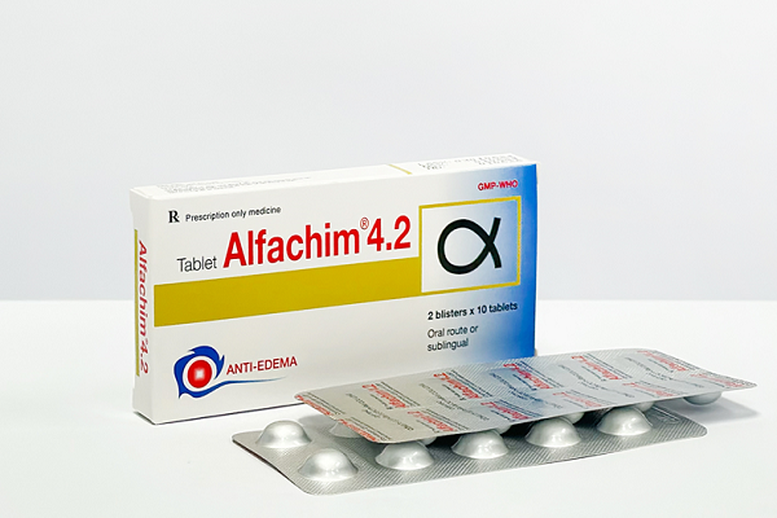
Rappel d'un lot de médicaments populaires pour le traitement des gonflements après un traumatisme ou une brûlure
Les comprimés d'Alfachim 4.2 sont des anti-œdèmes et des anti-inflammatoires utilisés dans le traitement des œdèmes après traumatismes, brûlures et interventions chirurgicales. Ce médicament est très couramment utilisé.
Le lot de médicaments rappelé est étiqueté comme étant des comprimés d'Alfachim 4.2 (chymotrypsine (équivalent à 21 microkatal de chymotrypsine) 4200 UI), numéro d'enregistrement de circulation : VD-34573-20, numéro de lot 03010624 ; date de fabrication : 1er juin 2024 ; date d'expiration : 1er juin 2026, fabriqué par Cuu Long Pharmaceutical Joint Stock Company.
Selon l'Administration des médicaments du Vietnam, en mai 2025, l'Institut central de contrôle des médicaments a testé l'échantillon de médicament ci-dessus, les résultats ne répondaient pas aux normes de qualité des indicateurs quantitatifs (violation de niveau 2).
À cette époque, l'Administration des médicaments a demandé le rappel de ce lot de médicaments à Hanoi ; en même temps, elle a demandé à la société par actions pharmaceutique Cuu Long de coordonner le prélèvement d'échantillons supplémentaires et de les envoyer à l'Institut central de dépistage des médicaments ou à l'Institut de dépistage des médicaments de Ho Chi Minh-Ville pour vérifier la qualité des indicateurs quantitatifs.
Cependant, passé le délai imparti, l'entreprise n'a toujours pas communiqué les résultats du test de qualité supplémentaire sur les échantillons, mais seulement les informations sur la production et la distribution du médicament, ainsi que le rapport de rappel. Elle a ensuite adressé un document à l'Agence américaine des médicaments (DHA), demandant le rappel volontaire de ce lot de médicaments.
Par conséquent, l'Administration des médicaments du Vietnam a décidé d'annoncer un rappel national de ce lot de médicaments et a demandé à la Société de se coordonner avec le distributeur pour rappeler rapidement l'ensemble du lot de médicaments qui ne répondent pas aux normes de qualité ; envoyer un rapport de rappel au Département avant le 8 juillet 2025.
Le Département a également demandé au Département de la Santé des provinces et des villes, ainsi qu'au Département de la Santé de tous les secteurs, d'informer les établissements de commerce et d'utilisation de médicaments afin de rappeler le lot de médicaments de qualité inférieure susmentionné, de publier des informations sur la décision de rappel de médicaments sur le site Web du Département, d'inspecter et de superviser les unités mettant en œuvre la notification, de traiter les contrevenants conformément à la réglementation en vigueur et de faire rapport au Département de l'administration des médicaments et aux autorités compétentes.
Les départements de la santé de Hanoi et de Vinh Long sont chargés d'inspecter et de superviser cette entreprise dans le cadre du rappel et de la manipulation du médicament, et d'évaluer l'efficacité du rappel, si le produit peut encore continuer à circuler et à être utilisé, et s'il présente un risque d'effets néfastes sur la santé des utilisateurs.
Suspension de 20 types de cosmétiques violant les réglementations en matière d'étiquetage et d'utilisation
Récemment, l'Administration des médicaments du Vietnam, ministère de la Santé, a également suspendu la circulation et rappelé 20 produits cosmétiques de Dai Cat A International Company Limited située au 43D/44 Ho Van Hue, Ward 9, Phu Nhuan District, Ho Chi Minh-Ville, responsable de leur mise sur le marché.
La raison du rappel est que certains produits enfreignent les réglementations en matière d’étiquetage et que leurs utilisations ne sont pas conformes aux documents de déclaration approuvés.
L'Administration des médicaments du Vietnam a également demandé aux ministères de la Santé des provinces et des villes de cesser immédiatement le commerce et l'utilisation de produits contrevenants, de demander des remboursements aux fournisseurs et de rappeler tous les produits contrevenants, ainsi que de surveiller et de traiter les violations conformément à la réglementation en vigueur.
Pour Dai Cat A International Company Limited, la Drug Administration exige qu'un avis de rappel soit envoyé à tous les points de distribution, que les produits soient rappelés des établissements commerciaux et détruits (si l'étiquette incriminée ne peut être séparée du produit) conformément aux dispositions du décret 126/2021/ND-CP.
Dai Cat A International Company Limited doit signaler les résultats du rappel à l'Administration des médicaments du Vietnam avant le 30 juin 2025.
L'Administration des médicaments du Vietnam a demandé au Département de la santé de Ho Chi Minh-Ville de surveiller la mise en œuvre du rappel et de signaler les résultats de la surveillance au Département avant le 10 juillet 2025.
Parallèlement à cette décision, le Département de l'administration des médicaments a également révoqué 20 numéros de reçus de formulaires de déclaration de produits cosmétiques de Dai Cat A International Company Limited. Parallèlement, le Département de l'administration des médicaments a temporairement suspendu l'examen et la réception des dossiers de déclaration de produits cosmétiques de Dai Cat A International Company Limited pour une période de six mois, à compter du 20 juin.
Hien Minh
Source : https://baochinhphu.vn/thu-hoi-lo-thuoc-pho-bien-dieu-tri-phu-ne-sau-chan-thuong-bong-102250623144940498.htm





































































































Comment (0)