파키스탄 당국은 스위스 제약 회사 로슈가 유통하는 암 치료제(아바스틴)에 대한 조사를 위해 해당 약물의 일시적 중단을 발표했습니다. 이는 12명의 환자가 이 약물을 주사받은 후 실명한 데 따른 것입니다.
이 정보와 관련하여 베트남 약품 관리국( 보건부 )은 9월 27일에 F. Hoffmann La Roche Ltd.의 대표 사무소에서 상기 약물 Avastin 과 관련된 조사에 대한 최신 정보를 보고하는 공식 문서를 발행했다고 발표했습니다.
베트남에서 Avastin은 다음과 같은 4가지 유효한 유통 등록 인증서를 보유하고 있습니다.
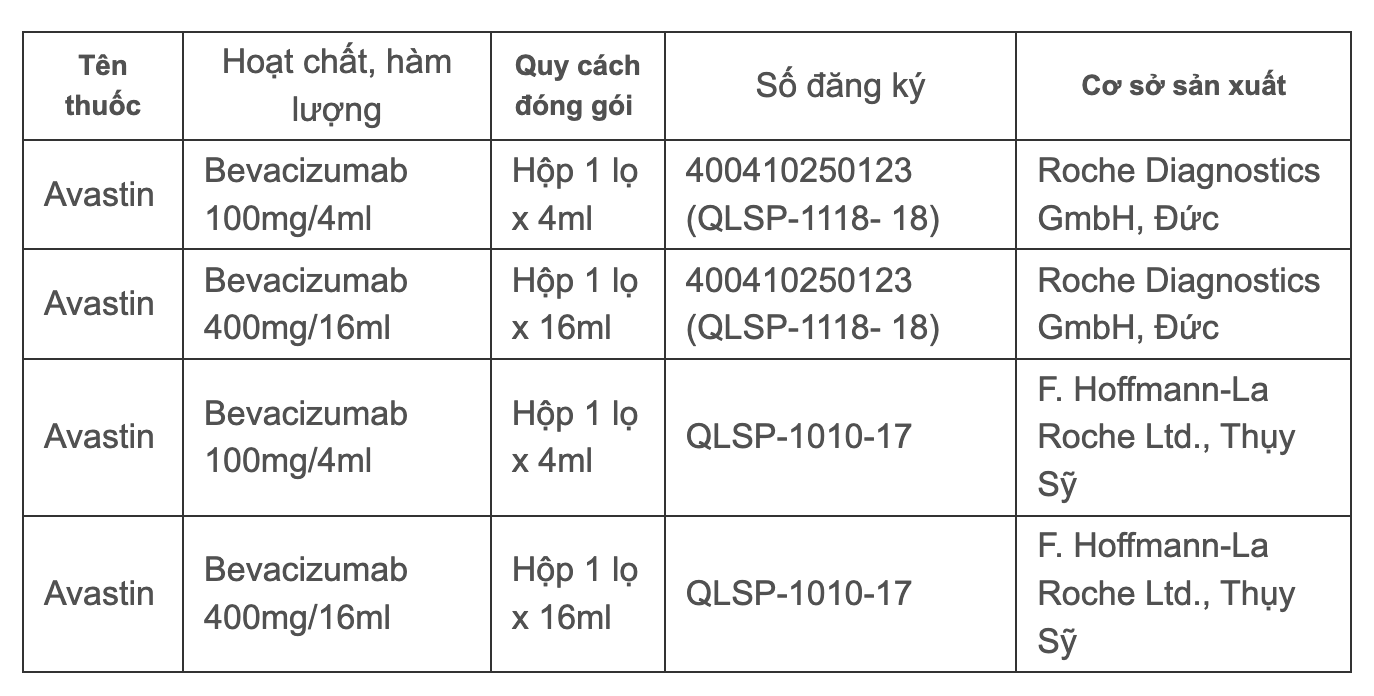
Avastin에 대한 유효한 등록증 4개
베트남 약물 관리국에 따르면, 아바스틴은 베트남에서 다음의 치료 적응증에 대해 유통 등록 인증서를 받았습니다: 전이성 대장암, 진행성, 전이성 또는 재발성 비소세포 폐암, 진행성 및/또는 전이성 신세포 암종, 신경교종/악성 신경교종(4기), 상피성 난소암, 나팔관암 및 원발성 복막암.
일반적인 경고 외에도 FDA 승인 제품 설명서에는 "유리체내 주사에 사용하지 마십시오."라는 경고가 포함되어 있습니다. 특히, 이 약물은 시각 장애를 유발할 수 있습니다. 암 환자에게 정맥 주입용 바이알에 들어 있는 아바스틴 혼합물을 유리체내 주사(승인되지 않은 투여 경로)한 후 심각한 안구 부작용 사례 및 군집이 보고되었습니다.
아바스틴은 암 치료에 사용됩니다.
이러한 반응에는 다음이 포함됩니다: 안구 내 감염, 무균성 안구 내염, 포도막염 및 유리체염과 같은 안구 내염, 망막 밴딩, 망막 색소 상피 파열, 안구 내압 상승, 유리체 출혈이나 망막 출혈과 같은 안구 내 출혈, 결막 출혈. 이러한 사건 중 몇몇은 영구 실명을 포함한 다양한 정도의 시력 상실로 이어졌습니다.
베트남 약물 관리국 관계자는 9월 27일 현재 아바스틴을 복용한 환자가 시력을 잃는 등 아바스틴의 부작용을 반영한 보고는 접수되지 않았다고 밝혔습니다.
F. Hoffmann La Roche Ltd. 대표 사무소 보고서에 따르면, 공식 발송 번호 RA/02/09/2023에서 Avastin 약물과 관련된 조사에 대한 최신 정보를 보고했으며, 파키스탄 약물 관리국에 보낸 정보에 따르면, 불법 공급업체인 Genius Pharmaceutical Service에서 제공한 주사제를 사용한 후 약 12명의 환자가 시력을 잃었습니다. 이 보고서에 따르면, 이 약은 "주사제 아바스틴 1.25mg/0.05ml"이라는 라벨이 붙어 있어 로슈 제품이라는 오해의 소지가 있습니다.
로슈의 아바스틴은 어떤 안과적 적응증에도 사용이 승인되지 않았습니다. Genius Pharmaceutical Service는 비위생적이고 승인되지 않은 조건에서 1.25mg/0.5ml의 용량으로 약물을 공급/희석/재포장했습니다.
[광고_2]
원천


![[사진] 안호앙-딘득, 냔단 전국탁구선수권대회 남자복식 우승 무사히 방어](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/23/d6ab3bcac02c49928b38c729d795cac6)


![[사진] 2025년 난단신문 전국탁구선수권대회 정상급 선수들이 모였다](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/23/9ad5f6f4faf146b08335e5c446edb107)






















































































댓글 (0)