For tiden fokuserer de fleste kliniske studiene i Vietnam på å utvikle nye produkter som legemidler, vaksiner, medisinsk utstyr og nye behandlingsteknikker. Spesielt de siste årene har det vært forskning på celleterapi og genterapi.
Kliniske studier krever grundig godkjenning og evaluering før implementering fordi testprosessen, nye produkter og teknikker kan utgjøre en risiko for de frivillige som deltar i studien.
I realiteten har det imidlertid gjennom årene vært studier godkjent av andre departementer og etater enn Helsedepartementet som har utført forskning på mennesker, men som ikke ble godkjent av den biomedisinske forskningsetiske komiteen.
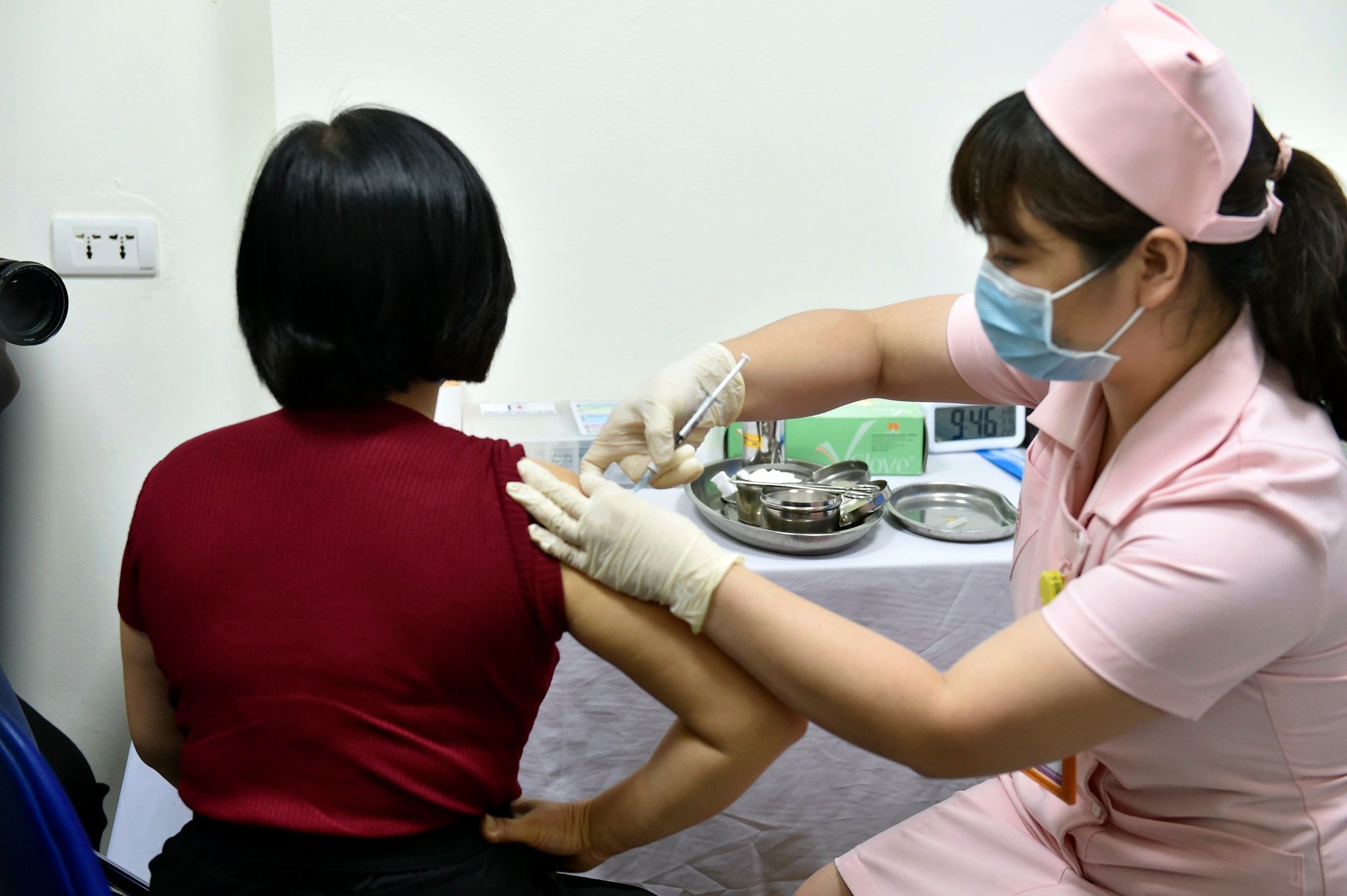
Covivac Covid-19-vaksinetestinjeksjoner ved Hanoi Medical University, mars 2021
Helsedepartementet ber om tilbakemeldinger på et utkast til rundskriv som regulerer forvaltningen av vitenskapelige og teknologiske oppgaver under deres ansvar. Utkastet foreslår at forskningsprosjekter som er finansiert av ikke-budsjettmessige kilder eller forvaltet av andre departementer og etater, men som involverer menneskelige studier, kun kan gjennomføres etter godkjenning fra Det biomedisinske forskningsetiske rådet og formell godkjenning fra Helsedepartementet. Samtidig understreker utkastet rollen til grasrotnivåråd i godkjenning av forskningsforslag, effektivisering av godkjenningstider i Helsedepartementet og sikring av forskningsfremdrift.
I Vietnam gjennomføres det omtrent 100 kliniske studier årlig, noe som skaper gunstige forhold for innenlands tilgang til nye teknologier, produkter og metoder innen behandling og helsevesen, spesielt for utfordrende sykdommer som kreft og hjerte- og karsykdommer. Når nye produkter og teknikker godkjennes, vil Vietnam også være blant de første som får tilgang til dem, inkludert legemidler og vaksiner. Før offisiell lisensiering kan imidlertid den kliniske studieprosessen medføre helse- og livsrisiko for frivillige. Derfor er streng godkjenning og overvåking gjennom hele implementeringsprosessen avgjørende.
I henhold til gjeldende regelverk er Helsedepartementet ansvarlig for å administrere, veilede og organisere gjennomføringen av biomedisinsk forskning på mennesker. Før vitenskapelige og teknologiske oppgaver som involverer biomedisinsk forskning på mennesker påbegynnes, må den ledende organisasjonen innhente godkjenning fra den biomedisinske forskningsetiske komiteen (som fastsatt i rundskriv nr. 04/2020/TT-BYT).
[annonse_2]
Kildekobling



![[Foto] To fly landet og tok av på Long Thanh lufthavn.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F15%2F1765808718882_ndo_br_img-8897-resize-5807-jpg.webp&w=3840&q=75)






























































































Kommentar (0)