Laut Professor Dr. Le Van Quang, Direktor des K-Krankenhauses, wird die Einheit in Kürze eingeführt. Pembroria-Medizin Pembroria wird in der Behandlung von Krebspatienten eingesetzt. Das Medikament (aus Russland) kostet etwa 18 Millionen VND pro Flasche; Patienten benötigen üblicherweise zwei Flaschen pro Behandlungszyklus. Die Behandlung dauert 12 bis 24 Zyklen oder bis der Patient nicht mehr auf das Medikament anspricht. Derzeit wird Pembroria nicht von den Krankenkassen übernommen.
Laut einem Vertreter der Arzneimittelbehörde ( Gesundheitsministerium ) hat Pembroria die klinischen Studien abgeschlossen und ist in Vietnam offiziell zugelassen. Das Medikament wird von Biocad (Russland) hergestellt und ist bei einem Unternehmen mit Hauptsitz in den Vereinigten Arabischen Emiraten registriert. Die Zulassung erlaubt den Import, den Vertrieb und die breite Anwendung des Medikaments; es zählt nicht zu den Spezial- oder eingeschränkt erhältlichen Arzneimitteln.
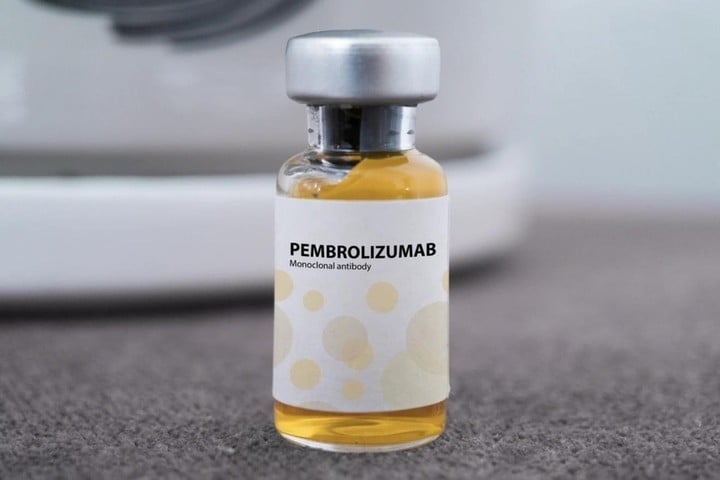
Pembroria ist im Wesentlichen ein Biosimilar von Keytruda, dem Originalpräparat von MSD (USA), das ebenfalls den Wirkstoff Pembrolizumab enthält. Dieser monoklonale Antikörper unterstützt das Immunsystem bei der Erkennung und Zerstörung von Krebszellen und gilt als eine der wirksamsten Immuntherapien. Keytruda wurde 2014 in den USA zugelassen und erhielt 2017 die Zulassung für Vietnam.
Die Markteinführung von Pembroria dürfte den Zugang zu Krebsbehandlungen für mehr Patienten verbessern, da die Kosten deutlich niedriger sind – etwa 18 Millionen VND pro Ampulle im Vergleich zu 55–65 Millionen VND für Keytruda. Allerdings werden beide Medikamente derzeit noch nicht von den Krankenkassen übernommen.
Pembrolizumab wirkt durch „schnelle Freisetzung“ an T-Immunzellen. Normalerweise Krebszellen Es sendet ein „Stopp“-Signal, das T-Zellen am Angriff hindert. Das Medikament blockiert dieses Signal und reaktiviert so die Fähigkeit der Zellen, Tumore zu zerstören. Es ist wirksam bei vielen Krebsarten wie Lungen-, Nieren-, Gebärmutterhalskrebs und Melanomen.
Laut der Arzneimittelbehörde wurden die vollständigen Zulassungsunterlagen für das Arzneimittel vom Unternehmen vorschriftsgemäß eingereicht. Bis 2024 hatte das Arzneimittel die klinischen Studien abgeschlossen. Das Unternehmen führte jedoch weiterhin eine Immunogenitätsprüfung durch – eine obligatorische Anforderung für Biosimilars wie dieses Produkt, keine neue klinische Studie.
Während des Vertriebsprozesses sind die Unternehmen verpflichtet, die Sicherheit, Wirksamkeit und Immunogenität des Arzneimittels nach 3 oder 5 Jahren gemäß den Vorgaben der zuständigen Behörde zu überwachen und regelmäßig darüber zu berichten.
Zuvor waren bereits zahlreiche Arzneimittel mit dem Wirkstoff Pembrolizumab im Land zugelassen. Mit Beschluss 628/QD-QLD vom 31. Oktober genehmigte die Arzneimittelbehörde 14 Impfstoffe und Biologika, darunter Pembroria (100 mg/4 ml), eine konzentrierte Infusionslösung mit einer Haltbarkeit von 24 Monaten ab Herstellungsdatum.
Quelle: https://baolangson.vn/thuoc-ung-thu-pembroria-cua-nga-vua-duoc-cap-phep-tai-viet-nam-co-gia-bao-nhieu-5064810.html


![[Foto] Generalsekretär To Lam besucht das Projekt des internationalen Flughafens Long Thanh](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1763008564398_vna-potal-tong-bi-thu-to-lam-tham-du-an-cang-hang-khong-quoc-te-long-thanh-8404600-1261-jpg.webp)



![[Foto] Die „Narben“ der Berge und Wälder von Da Nang nach Stürmen und Überschwemmungen](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1762996564834_sl8-jpg.webp)






















































































![Dong Nai OCOP-Übergang: [Artikel 3] Verknüpfung von Tourismus und OCOP-Produktkonsum](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Kommentar (0)