בשנים האחרונות, שינוי משמעותי בהבנתנו את הסרטן הוא ההבנה שמיקרואורגניזמים שוכנים לא רק במעיים אלא גם ברקמת הגידול - כולל גידולים מוצקים כמו גידולי השד, הערמונית והריאות. קהילות מיקרוביאליות אלו (הנקראות יחד המיקרוביום התוך-גידולי או המיקרוביום הקשור לגידול) מקיימות אינטראקציה ישירה עם תאי סרטן, תאי חיסון והסביבה הסובבת אותם, ובכך משפיעות על הביולוגיה של הגידול, תגובת הטיפול והפרוגנוזה.
האם המיקרוביוטה ברקמת הגידול שונה מהמיקרוביוטה במעי?
רקמת גידול נחשבה בעבר ל"אזור סטרילי", אך ניתוחים גנומיים וריצוף עדכניים חשפו DNA/RNA מיקרוביאלי בדגימות גידול רבות שנכרתו. חיידקים אלה עשויים לשכון בתוך תאי סרטן, בתוך תאי חיסון או להיות משובצים ברקמת החיבור שמסביב. הרכב וצפיפות החיידקים משתנים בין סוגי הגידולים והמטופלים - לדוגמה, לגידולי שד יש מגוון מיקרוביאלי גבוה יחסית בהשוואה לגידולים אחרים - ומיקומם (תוך-תאי לעומת חוץ-תאי) קובע כיצד הם משפיעים על הרקמה החולה.
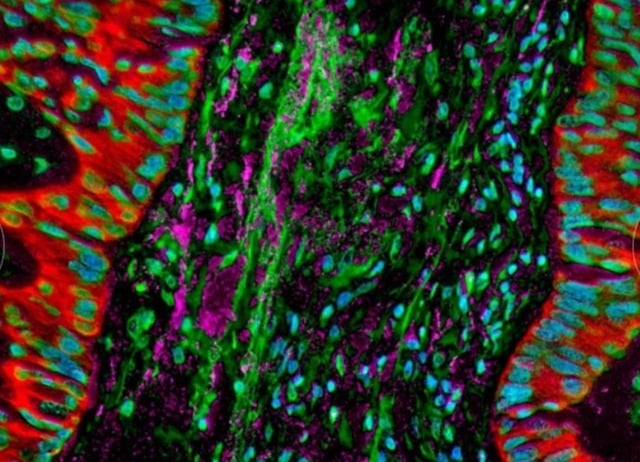
תמונות מיקרוסקופיות מראות חיידקים השוכנים בתאי סרטן ריאות, ומשנים את התגובה החיסונית של הגוף.
תפקידם של חיידקים ווירוסים ברקמת השד, הערמונית והריאות
מיקרוביוטה מקומית יכולה לווסת את הסביבה החיסונית בצורה מדכאת או מפעילה. חלק מהמיקרובים מפעילים אותות דלקתיים כרוניים (למשל, באמצעות קולטני זיהוי תבניות כמו TLRs), מה שמוביל לעלייה בציטוקינים מעודדי דלקת, המושכים תאי חיסון מדכאים (מקרופאגים M2, Tregs) - ובכך עוזרים לגידולים להתחמק מחסינות. לעומת זאת, חלק מהחיידקים או הנגיפים יכולים לעורר חסינות תאית (הצגת אנטיגן מוגברת, הפעלת תאי T CD8+) ולתרום ליעילות האימונותרפיה. לפיכך, אותה מיקרוביוטה יכולה להיות "ידידה" או "אויבת" בהתאם להקשר.
חלק מהחיידקים מייצרים רעלים או תרכובות שפוגעות ב-DNA, גורמות למוטציות ומעודדות את התקדמות הסרטן. לעומת זאת, חיידקים אחרים יכולים לגרום למטבוליזם שמפחית את צמיחת תאי הגידול. ברקמת השד, מחקרים תיעדו את נוכחותם של חיידקים המעורבים במסלולים דלקתיים ומטבוליים; בערמונית, שינויים מיקרוביאליים קשורים להתקדמות המחלה ולתגובה לטיפול אנטי-אנדרוגני; ובריאה, המיקרוביום האנדוגני עשוי לקיים אינטראקציה עם דלקת הנגרמת על ידי עישון ולשנות את המיקרו-סביבה כדי להפוך את הגידולים לפחות מגיבים לאימונותרפיה.
נוכחותו או הרכבו של המיקרוביום התוך-גידולי יכולים לשנות את יעילות הכימותרפיה, הקרנות, ובמיוחד אימונותרפיה. המנגנונים כוללים שינויים במיקרו-סביבה (pH, תזונה), חוסר פעילות מקומית של תרופות (לחלק מהחיידקים יש אנזימים המפרקים תרופות), או אפנון של הצגת אנטיגנים וחדירת תאי מערכת החיסון. מספר מחקרים הראו כי הבדלים במיקרוביוטה של הגידול קשורים לתגובה או עמידות למעכבי נקודות בקרה חיסוניות (ICIs).
שינוי מקומי של המיקרוביום ברקמת הגידול - אסטרטגיות קיימות ומחקריות
הרעיון של התערבות ישירה במיקרוביום הגידול פותח דרכי טיפול חדשות. חלק מהגישות שפותחו או נמצאות בפיתוח כוללות:
בכמה מודלים ניסיוניים, שימוש באנטיביוטיקה כדי לחסל מינים "רעים" בגידולים שינה את תגובות הרקמות לתרופות. עם זאת, לאנטיביוטיקה סיסטמית יש השפעות נרחבות (ועלולות להפריע למיקרוביום המעי הנחוץ לחסינות), ולכן שימוש מקומי באנטיביוטיקה או פיתוח אנטיביוטיקה סלקטיבית למיני המטרה הוא בראש סדר העדיפויות.
הרעיון הוא להחדיר לרקמת הגידול חיידקים מהונדסים אשר מפרישים ציטוקינים המעוררים את מערכת החיסון, אנזימים מטבוליים המשנים את רמת החומציות (pH), או אנזימים המפרקים חומרים מדכאי חיסון. מספר ניסויים פרה-קליניים המשתמשים בחיידקים מוחלשים להעברת תרופות באופן מקומי הראו פוטנציאל.
נחקרו נגיפים אונקוליטיים ככאלה שהורגים ישירות תאי סרטן ובו זמנית מגרים חסינות נגד גידולים. שילוב של נגיפים אונקוליטיים עם עריכת מיקרוביום יכול לשפר את הפעלת תאי T מקומיים ולהרחיב תגובות מערכתיות.
למרות שהנושא כאן הוא מיקרוביולוגיה מקומית, חשוב לציין שקיים ציר בין מעי לגידול: שינויים במיקרוביום המעי (למשל, באמצעות תזונה, פרוביוטיקה, FMT) יכולים לשנות בעקיפין את המיקרוביום התוך-גידולי ואת החסינות המערכתית, ובכך להשפיע על רקמת הגידול בריאה, בשד או בערמונית.

מדענים מנתחים DNA מיקרוביאלי ברקמת גידול כדי למצוא מינים המשפיעים על יעילות הטיפול בסרטן.
אתגרים קליניים ושיקולים
- הבחנה בין "סיבה" ל"תוצאה": מחקרים רבים עדכניים עדיין מתארים קורלציות אך לא אישרו קשר סיבתי בין מיקרוביולוגיה להתקדמות הגידול.
- סטנדרטיזציה טכנית: דגימה, בידוד DNA/RNA, הימנעות מזיהום חיצוני וניתוח ביואינפורמטיקה - כל אלה דורשים סטנדרטיזציה לקבלת תוצאות אמינות.
- שונות גבוהה בין מטופלים: המיקרוביום תלוי באדם; יש להתאים את ההתערבויות באופן אינדיבידואלי.
- בטיחות: החדרת חיידקים או וירוסים חיים לרקמת הגידול כרוכה בסיכון לזיהום או לתגובת יתר של מערכת החיסון; טיפולים אלה דורשים בדיקות קפדניות.
חקר המיקרוביום הקשור לגידול פותח שכבה חדשה של ביולוגיה באונקולוגיה: המיקרוביום המקומי יכול להיות גם מקדם סרטן וגם כלי לוויסות חיסוני ומתן תרופות ממוקד לגידולים. עם ההתקדמות בטכניקות ריצוף, היסטולוגיה, ביומימיקרי והנדסת מיקרוביום, העתיד הקרוב מבטיח שאסטרטגיות טיפוליות המכוונות או מנצלות את המיקרוביום המקומי - החל מחיידקים מהונדסים ביולוגית, פאג'ים סלקטיביים ועד נגיפים אונקולטיים בעלי יכולת חיסון - יהפכו לחלק מטיפול רב-מודאלי.
עם זאת, הדרך הקליני עדיין ארוכה; סטנדרטיזציה של בדיקות, הוכחת סיבתיות והבטחת בטיחות יהיו תנאים מוקדמים לפני שהתערבויות אלו יאומצו באופן נרחב.
מקור: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm




























































































![מעבר דונג נאי OCOP: [סעיף 3] קישור תיירות עם צריכת מוצרי OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)












תגובה (0)