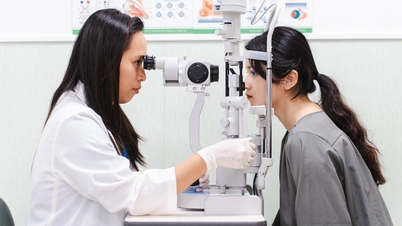
Ο Δρ. Nguyen Van Loi, Προϊστάμενος του Τμήματος Εγγραφής Φαρμάκων (Τμήμα Διοίκησης Φαρμάκων - Υπουργείο Υγείας ), δήλωσε: Μετά από περισσότερα από 7 χρόνια εφαρμογής του Νόμου περί Φαρμακευτικής του 2016, εκτός από τα αποτελέσματα που έχουν επιτευχθεί, ορισμένοι κανονισμοί που σχετίζονται με την καταγραφή της κυκλοφορίας φαρμάκων και τα συστατικά των φαρμάκων έχουν αποκαλύψει ελλείψεις που πρέπει να διορθωθούν.
Όσον αφορά τον φάκελο, την εντολή και τις διαδικασίες για την παράταση της ισχύος του Πιστοποιητικού Κυκλοφορίας για φάρμακα και φαρμακευτικά συστατικά, ορίζεται ότι όλοι οι φάκελοι για την παράταση του Πιστοποιητικού Κυκλοφορίας πρέπει να περάσουν από τη διαδικασία αξιολόγησης και έγκρισης του Γνωμοδοτικού Συμβουλίου για τη χορήγηση του Πιστοποιητικού Κυκλοφορίας. Αυτή η διάταξη του Νόμου περί Φαρμακευτικής του 2016 έχει συμβάλει στη διασφάλιση της ποιότητας, της ασφάλειας και της αποτελεσματικότητας των φαρμάκων που κυκλοφορούν. Ωστόσο, για φάρμακα που κυκλοφορούν στην αγορά και δεν λαμβάνουν σχόλια σχετικά με την ποιότητα, την ασφάλεια για τους χρήστες ή δεν έχουν συστάσεις από τον Παγκόσμιο Οργανισμό Υγείας , εξακολουθεί να είναι απαραίτητο να περάσουν από το Γνωμοδοτικό Συμβούλιο, γεγονός που μπορεί να αυξήσει τον χρόνο επεξεργασίας και να επιβαρύνει το Γνωμοδοτικό Συμβούλιο.
Συνεπώς, είναι απαραίτητο να διαφοροποιηθούν οι φάκελοι για την ανανέωση του Πιστοποιητικού Κυκλοφορίας που πρέπει ή δεν πρέπει να αξιολογούνται και να εγκρίνονται από το Γνωμοδοτικό Συμβούλιο για τη χορήγηση του Πιστοποιητικού Κυκλοφορίας, ώστε να διασφαλίζεται η συνεχής κυκλοφορία φαρμάκων και φαρμακευτικών συστατικών, διασφαλίζοντας παράλληλα την ασφάλεια και την αποτελεσματικότητα για τους χρήστες.
Από την άλλη πλευρά, ο κανονισμός σχετικά με τους φακέλους για την παράταση της ισχύος του Πιστοποιητικού Εγγραφής Κυκλοφορίας απαιτεί την υποβολή έξι τύπων εγγράφων, κυρίως διοικητικών εγγράφων. Η υποχρέωση υποβολής πολλών εγγράφων στον φάκελο έχει οδηγήσει σε σπατάλη χρόνου και πόρων για τις επιχειρήσεις κατά την προετοιμασία των φακέλων, καθώς και σε άσκηση πίεσης στον φορέα διαχείρισης όσον αφορά την αξιολόγηση και την έγκριση των φακέλων. Επί του παρόντος, το Υπουργείο Υγείας έχει αναπτύξει ένα ηλεκτρονικό σύστημα αδειοδότησης και στο εγγύς μέλλον θα συνδέσει την εθνική φαρμακευτική βάση δεδομένων, ώστε να είναι δυνατή η πλήρης αναζήτηση αυτών των εγγράφων, επομένως δεν υπάρχει ανάγκη υποβολής εκ νέου.
Η αλλαγή και προσθήκη του Πιστοποιητικού Κυκλοφορίας Φαρμάκων και Φαρμακευτικών Συστατικών πρέπει να εγκριθεί με την αξιολόγηση του φακέλου και τη διαβούλευση με το Γνωμοδοτικό Συμβούλιο για την έκδοση του Πιστοποιητικού Κυκλοφορίας Φαρμάκων και Φαρμακευτικών Συστατικών. Ωστόσο, στην τρέχουσα πραγματικότητα, η ρύθμιση αυτή είναι περιττή, προκαλώντας σπατάλη χρόνου για τις επιχειρήσεις και ταυτόχρονα δημιουργώντας πίεση στον χρόνο διεκπεραίωσης διοικητικών διαδικασιών για τις κρατικές υπηρεσίες διαχείρισης σε περιπτώσεις απλών διοικητικών αλλαγών (αλλαγή ταχυδρομικής διεύθυνσης, αλλαγή ονόματος, διεύθυνσης μονάδας παραγωγής, καταχώριση φαρμάκων, προσθήκη κωδικού QR κ.λπ.), επειδή αυτές οι αλλαγές και προσθήκες δεν σχετίζονται με την τεχνική εμπειρογνωμοσύνη, την ασφάλεια και την αποτελεσματικότητα του φαρμάκου.
Οι κανονισμοί σχετικά με τις κλινικές δοκιμές φαρμάκων κατά την εγγραφή για κυκλοφορία φυτικών φαρμάκων με νέους συνδυασμούς φαρμακευτικών βοτάνων που έχουν χρησιμοποιηθεί ως φάρμακα στο Βιετνάμ δεν είναι επίσης κατάλληλοι και δεν συνάδουν πλήρως με τον ισχύοντα νέο μηχανισμό διαχείρισης φαρμάκων στο Βιετνάμ και σε άλλες χώρες της περιοχής.
 |
Ο Υπουργός Υγείας Ντάο Χονγκ Λαν ανέφερε, εξήγησε, αποδέχτηκε και διευκρίνισε ορισμένα ζητήματα του Νόμου που τροποποιεί και συμπληρώνει ορισμένα άρθρα του Νόμου περί Φαρμακευτικής στη συνεδρίαση του απογεύματος της 26ης Ιουνίου. |
Με βάση τις ελλείψεις, το σχέδιο νόμου που τροποποιεί και συμπληρώνει ορισμένα άρθρα του νόμου περί φαρμακευτικής έχει κάνει προσαρμογές για την απλούστευση του φακέλου ανανέωσης, αλλαγής και συμπλήρωσης του Πιστοποιητικού Κυκλοφορίας φαρμάκων και φαρμακευτικών συστατικών· ρυθμίζει τις περιπτώσεις ανανέωσης, αλλαγής και συμπλήρωσης του Πιστοποιητικού Κυκλοφορίας χωρίς να απαιτείται η έκδοση του Πιστοποιητικού Κυκλοφορίας ή χωρίς να αναμένει την έγκριση του Υπουργείου Υγείας για την απλούστευση των διοικητικών διαδικασιών. Συγκεκριμένα, μειώνει τον χρόνο επεξεργασίας των φακέλων αλλαγών και συμπληρωμάτων που χρειάζεται μόνο να ανακοινωθούν από 3 μήνες σε 15 εργάσιμες ημέρες· προσθέτει κανονισμούς που επιτρέπουν στα ιδρύματα να συνεχίσουν να χρησιμοποιούν το Πιστοποιητικό Κυκλοφορίας μετά τη λήξη του και έχουν υποβάλει αίτηση ανανέωσης σύμφωνα με τους κανονισμούς μέχρι να ανανεωθεί ή να λάβει έγγραφο από το Υπουργείο Υγείας.
Επιτρέπεται η αντικατάσταση του Πιστοποιητικού Φαρμακευτικού Προϊόντος (ΠΦΠ) με έγγραφα που αποδεικνύουν ότι το φάρμακο έχει άδεια κυκλοφορίας σε περίπτωση που πληροί τις ανάγκες πρόληψης και ελέγχου ασθενειών· εξαιρείται από την υποβολή κλινικών αρχείων στην αίτηση για Πιστοποιητικό Κυκλοφορίας για νέα φάρμακα (εκτός από εμβόλια) που παράγονται εγχώρια με ενδείξεις χρήσης για την πρόληψη και θεραπεία ασθενειών ομάδας Α που έχουν κηρυχθεί επιδημίες σύμφωνα με τις διατάξεις του νόμου για την πρόληψη και τον έλεγχο λοιμωδών ασθενειών και έχουν τα ίδια δραστικά συστατικά, δοσολογικές μορφές, οδούς χορήγησης και ενδείξεις με φάρμακα που έχουν λάβει άδεια κυκλοφορίας ή άδεια χρήσης σε περιπτώσεις έκτακτης ανάγκης ή άδεια κυκλοφορίας και χρήσης υπό όρους από την υπηρεσία αυστηρής χορήγησης φαρμάκων (SRA).
Όσον αφορά την προθεσμία για τη χορήγηση Πιστοποιητικού Κυκλοφορίας σε περιπτώσεις αναφοράς, αυτή δεν υπερβαίνει τους 9 μήνες από την ημερομηνία παραλαβής των πλήρων εγγράφων για νέα φάρμακα, βιολογικά προϊόντα αναφοράς, παρόμοια βιολογικά προϊόντα και εμβόλια, με έκθεση σχετικά με τα αποτελέσματα αξιολόγησης από έναν φορέα αυστηρής χορήγησης φαρμάκων (SRA) σύμφωνα με τους κανονισμούς του Υπουργού Υγείας.
Το αργότερο εντός 10 εργάσιμων ημερών από την ημερομηνία παραλαβής του πλήρους φακέλου, το Υπουργείο Υγείας αξιολογεί τον διοικητικό φάκελο για την έκδοση Πιστοποιητικού Κυκλοφορίας με βάση την αναγνώριση των αποτελεσμάτων αδειοδότησης της Υπηρεσίας Αυστηρής Διαχείρισης Φαρμάκων (SRA) για τον φάκελο καταχώρισης νέων φαρμάκων με ενδείξεις χρήσης στην πρόληψη και θεραπεία ασθενειών ομάδας Α που έχουν κηρυχθεί επιδημίες σύμφωνα με τις διατάξεις του νόμου για την πρόληψη και τον έλεγχο των λοιμωδών νοσημάτων· αναθέτει στην εγκατάσταση καταχώρισης φαρμάκων την ευθύνη για την ακρίβεια και τη νομιμότητα του τεχνικού φακέλου και του φακέλου αξιολόγησης της συμμόρφωσης με τις Ορθές Πρακτικές Παρασκευής για τις εγκαταστάσεις παραγωγής φαρμάκων. Το Υπουργείο Υγείας επιθεωρεί και αξιολογεί την τεχνική εμπειρογνωμοσύνη του τεχνικού φακέλου και του φακέλου αξιολόγησης της συμμόρφωσης με τις Ορθές Πρακτικές Παρασκευής για τις εγκαταστάσεις παραγωγής φαρμάκων μετά την έκδοση του Πιστοποιητικού Κυκλοφορίας.
Τα φάρμακα και τα φαρμακευτικά συστατικά που έχουν λάβει Πιστοποιητικό Κυκλοφορίας αλλά δεν κυκλοφορούν στην αγορά εντός περιόδου 5 ετών από την ημερομηνία έκδοσής τους δεν θα παρατείνουν το Πιστοποιητικό Κυκλοφορίας τους, με εξαίρεση τα σπάνια φάρμακα, τα φάρμακα για τη θεραπεία σπάνιων ασθενειών ή τα φάρμακα για τα οποία υπάρχουν έως και 3 έγκυρα Πιστοποιητικά Κυκλοφορίας.
Κατάργηση του κανονισμού σχετικά με τις κλινικές δοκιμές φυτικών φαρμάκων που περιέχουν νέους συνδυασμούς φυτικών φαρμάκων που έχουν χρησιμοποιηθεί ως φάρμακα στο Βιετνάμ και ενδείκνυνται για ασθένειες που περιλαμβάνονται στον κατάλογο που έχει εκδώσει ο Υπουργός Υγείας.
[διαφήμιση_2]
Πηγή: https://nhandan.vn/sua-doi-nhieu-chinh-sach-ve-dang-ky-luu-hanh-thuoc-nguyen-lieu-lam-thuoc-post816365.html



![[Φωτογραφία] Ο Γενικός Γραμματέας Το Λαμ παρευρίσκεται στη Διάσκεψη Υψηλού Επιπέδου για την Οικονομία Βιετνάμ-Ηνωμένο Βασίλειο](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/30/1761825773922_anh-1-3371-jpg.webp)
![[Φωτογραφία] Ο Γενικός Γραμματέας Τό Λαμ συναντά τον πρώην Βρετανό πρωθυπουργό Τόνι Μπλερ](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/30/1761821573624_tbt-tl1-jpg.webp)
![[Φωτογραφία] Ο Πρόεδρος της Εθνοσυνέλευσης, Τραν Ταν Μαν, δέχεται ξένους πρέσβεις που ήρθαν να τον αποχαιρετήσουν](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/30/1761820977744_ndo_br_1-jpg.webp)
![[Φωτογραφία] Το Τρίτο Πατριωτικό Συνέδριο Μίμησης της Κεντρικής Επιτροπής Εσωτερικών Υποθέσεων](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/30/1761831176178_dh-thi-dua-yeu-nuoc-5076-2710-jpg.webp)
![[Φωτογραφία] Συγκινητική σκηνή χιλιάδων ανθρώπων που σώζουν το ανάχωμα από το ορμητικό νερό](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/30/1761825173837_ndo_br_ho-de-3-jpg.webp)


































































































Σχόλιο (0)