第15期国会第8回会議11月21日午後の会議で、国会は代表者の大多数の賛成を得て、薬事法のいくつかの条項を改正および補足する法律を正式に可決した。

代表者の88.94%の賛成投票により、薬事法のいくつかの条項を改正および補足する法律が第15期国会第8回会議で正式に可決されました。
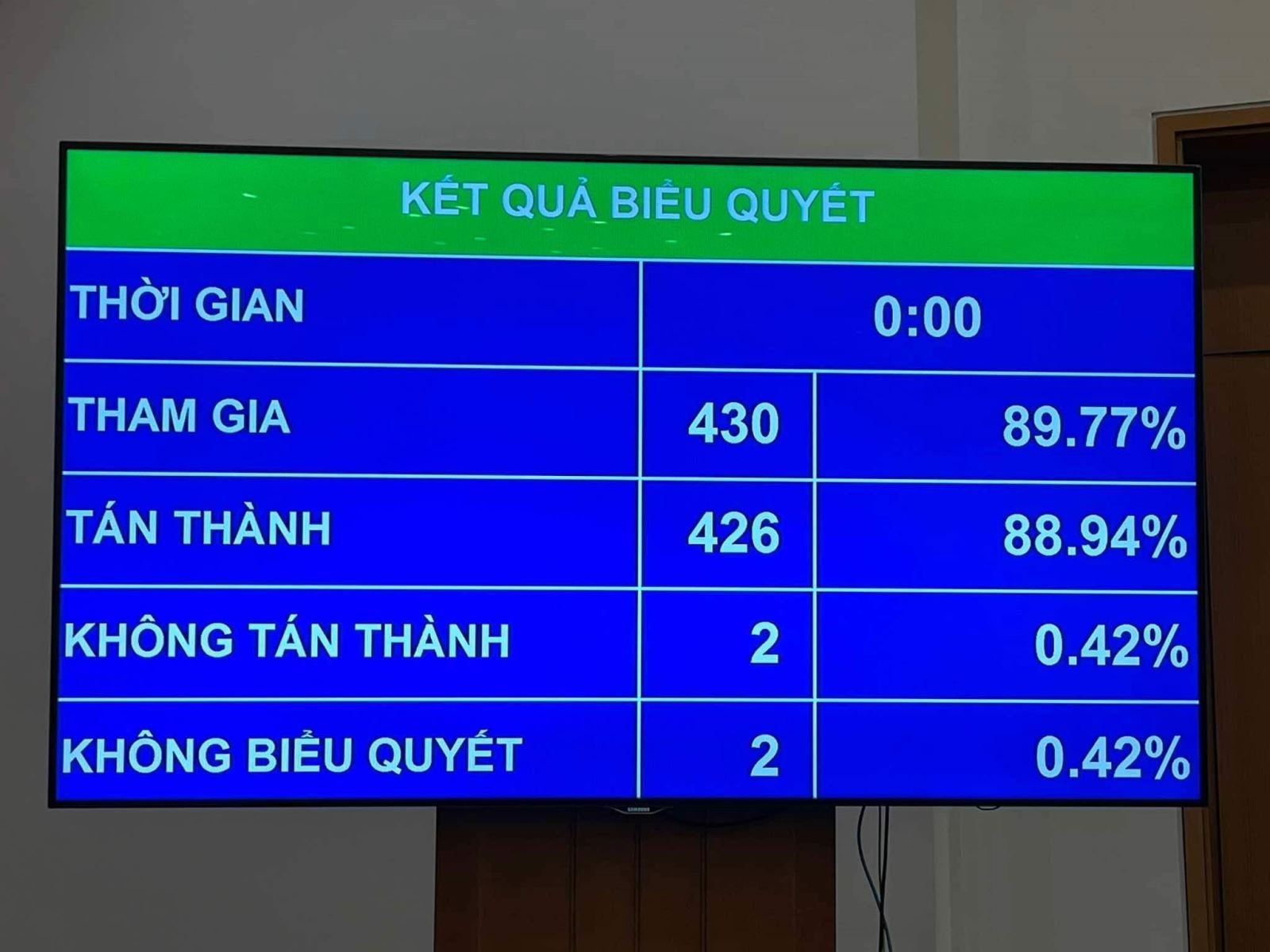
国会議員が薬学法のいくつかの条項を修正および補足する法案全体を承認する投票を行う前に、国会は、以下の2つの法律の内容を承認する投票を行いました。
薬局チェーンを組織する施設及び薬局チェーン内の薬局の権利と責任に関する第1条第23項について。投票の結果、代表者の89.14%が賛成しました。
医薬品および医薬成分の流通に関する登録証明書の発行および更新の権限、記録、手順、期間に関する第 1 条第 30 項について投票します。投票結果は代表者の86.22%が賛成した。
投票前に、国会社会委員会のグエン・トゥイ・アン委員長が、薬学法のいくつかの条項を修正および補足する法律案の受理、説明および修正に関する報告書を読み上げた。
具体的には、国の医薬品及び医薬品産業の発展に関する政策(第7条及び第8条(改正))について、国会常任委員会は代表者の意見を踏まえ、第7条(改正)が主要な原則内容を反映するように見直し、第14項に「各時期の社会経済状況に応じて、同一の有効成分及び医薬原料を有する医薬品の医薬品流通登録証の数を制御する政策がある」、第15項に「情報技術インフラの整備に投資を優先し、医薬品活動におけるデジタルトランスフォーメーションを実施する」という条項を追加するよう指示した。ただし、この政策、特に第8条、第13条、第14条の規定が実際に実行されるよう、国会常任委員会は政府に引き続きこの条の詳細を規定するよう指示する許可を求める。
産業発展における優遇政策と投資支援に関しては、代表者の大多数の意見に基づき、国会常任委員会はオプション1に従って第8条第1項を採択することに政府と合意した。オプション1は、投資登録証明書の交付または投資政策の承認の日から3年以内に少なくとも1兆ドンを支出し、総投資資本が3兆ドン以上の医薬品分野の新規設立プロジェクトに特別な優遇措置と投資支援を適用することを許可するというものである。同時に、国会常任委員会は、医薬品分野における優遇政策と特別投資支援の一貫性を確保するため、法人税法案(改正)を含む税法および関連法の改正の際に、税制優遇措置の明示に留意するよう政府に要請した。
薬局チェーン事業に関して(第17a条(補足)、第31条、第32条、第33条、第36条、第37条、第38条(改正)、第47a条(補足))、国会常任委員会は、代表者の意見に基づいて、薬局チェーンに関する規定を検討および改正し、第47a条(補足)第2項g点に示されているように、チェーン内の薬局の薬学専門知識の責任者のローテーションを規制するために保健大臣を指定すること、薬局チェーン組織施設が6か月以上一時的に営業を停止する場合にチェーン内の薬局が一時的に営業を停止する責任を規定すること(第47a条(補足)第4項d点)、および薬局チェーン組織施設が営業を停止する場合に営業を終了する責任を規定すること(第47a条(補足)第4項d点)を含む内容を含めました。
電子商取引による医薬品及び医薬品原料の取引について(第6条、第32条、第42条(改正))代表者の意見に基づき、実際に発生する可能性のある状況にタイムリーに対処できるようにするため、国会常任委員会は、法案草案で規定された権利と責任に加えて、第42条第4項h点(改正)において、電子商取引方式を採用する医薬品事業所は、電子商取引方式による医薬品、医薬品原料の卸売、小売に関する政府の規制を遵守しなければならないと規定する条項を追加しました。同時に、第42条第4項(改正)において、医薬品営業者が電子商取引方式で営業する場合の権利と責任に関する規定をまとめた。
医薬品流通登録証の発給、延長、変更、補充に関して(第56条(改正))、国会常任委員会は、立法建設における革新思考の原則を実施し、法律で具体的に規定するのではなく、保健福祉部長官に第56条の医薬品及び医薬品成分流通登録証の発給、延長、変更、補充に関する書類と手続きを規定するよう指示する方向に、第56条の改正内容を改正した。
また、重複する医薬品に対する新規流通登録証の発行を制限し、登録料の安さを理由に流通登録を「留保」する政策の悪用を制限するための規定を検討・補足するよう提言する代表者の意見を受け入れ、当面は、第56条第7項(改正)において、市場に5年間流通していない医薬品に対する流通登録証の有効期間は延長しないと規定した。同時に、第7条第14項(改正)では、国が同一の有効成分を有する医薬品や薬草に対する医薬品流通登録証の数を管理する政策を有すると規定し、政府に詳細な規定を定めるよう割り当てている。
医薬品の価格管理に関して(第2条第44項、第45項、第46項、第47項の用語説明、第107条、第109条、第110条、第112条、第113条(改正)、第114条の廃止):国会常任委員会は、代表者の意見を取り入れ、処方薬に適用予定の卸売価格の告示に関する措置を規制する政府の提案を検討し、同意した。これは、処方薬が市場の大きな割合を占め、医療現場で広く使用され、患者は医師の処方箋に従って購入する必要があることから、薬価管理における具体的な措置である。さらに保健省は、各段階、中間段階を通じて医薬品の価格上昇を抑制し、消費者に届く時点で価格を上げるために、医薬品事業者に医薬品の予想卸売価格を勧告しています。同時に、診療施設内の医薬品販売店で販売される医薬品の最大小売利益に関する現行規制を維持する。
価格申告措置に関する代表者提案については、この内容は価格に関する法律に基づいて実施されるため、国会常任委員会は、政府が2023年価格法の指導文書と詳細規則を見直し、価格申告義務のある事業所のリスト選定基準に関する規定を補足し、地方における一貫性と透明性のある実施を確保することを提案した。同時に、実施プロセスを綿密に監視し、処理上の困難や問題を迅速に検出します。保健省は、価格に関する法律の規定に従って完全なガイダンスを確保するために、必須医薬品のリストを定期的に更新することが求められています。
実施規定について(第3条):代表者の意見を受けて、国会常任委員会は法案第3条に示されているように実施効と経過規定を修正し、これにより、この法律は2025年7月1日から発効し(第3条第1項)、医薬品業務の困難を直ちに克服するために、医薬品および医薬品原料の流通登録証の延長に関する規定と医薬品製造、輸入、卸売業者による医薬品および医薬品原料の卸売に関する規定(第3条第2項)については2025年1月1日からのみ適用されます。
国会議員の意見は真剣に検討され、十分に吸収され、法案は次のような具体的な内容で修正されました: (i)「非処方薬」と「ハイテク医薬品」の概念; (2)薬局チェーン組織における医薬品に関する専門知識の責任者は薬剤師の学位を有し、適切な薬局施設で2年間の専門的実務経験を有していなければならないことを規定する。 (iii)製造施設、輸出入施設、医薬品・医薬原料卸売施設、外資系医薬品企業の権利に関する規制の透明性と一貫性を確保する。 (iv)第60条第2項iに基づき、診療施設がベトナム国内の流通登録証明書を持たない医薬品を、施設の患者の特別な治療ニーズに対応するために輸入することを認め、第60条第7項dに基づき、政府に対し医薬品の移送について詳細に定めるよう指示する。 (v) 保健大臣に、(現在の政府に代わって)医薬品情報の形式と方法を規定し、法案のほとんどの条項と条文の文言、スタイル、立法手法を改正する権限を与える。
改正法案は3条から構成され、その第1条では50条を改正し、現行薬事法の2項目、2条項、1条を廃止し、3条を新たに追加する。第2条は、価格法第16/2023/QH15号とともに発行された付録第01号を修正および補足します。第3条 実施条件について
受付・説明・調整の内容については、報告書第1062号に主要内容6件、個別内容10件、その他内容として具体的に記載されています。
現行法と比較すると、法案草案には次の 7 つの基本的な新しいポイント グループがあります。
国家の医薬品政策は、ベトナムの医薬品産業を先導的な産業に発展させるという目標を掲げ、党の見解を制度化し、引き続き改善されつつあります。したがって、この法律案は、2016年の薬事法と比較して、流通登録証明書や輸入ライセンスを付与する際の行政手続きに関する優遇政策など、投資を誘致し、医薬品および医薬品原料の生産の研究開発をさらに促進するための、より革新的な規定を数多く追加しています。研究、開発、臨床試験、技術移転、医薬品生産、医薬品原料などの科学技術活動に対して、優遇措置や支援基金からの支援を適用する政策。生産技術移転による一部の医薬品群の価格維持・価格引き下げ政策。医薬品活動におけるデジタル変革政策。医薬品分野における優遇措置や特別投資支援の対象となるプロジェクトの規模を決定し、実現可能性を確保し、医薬品および医薬品産業の発展に関する国の政策を実現するための詳細な規制を政府に課します。
新しいビジネス形態と方法のための法的回廊を創設します。これは、(i) 別個の種類の医薬品ビジネス施設としての薬局チェーンの設立、薬局チェーン設立のビジネス条件、権利と責任、薬局チェーン内の薬局、特に医薬品をローテーションする権利、薬局チェーン内の薬局間で医薬品の専門知識を担当する人をローテーションする権利を規制することです。 (2)電子商取引による医薬品及び医薬品原料の取引に関する規制、具体的には、電子的手段、電子商取引で取引が認められる医薬品及び医薬品原料の種類に関する規制の補足。この方法により医薬品営業施設の権利と責任を補完します。
国家管理の公開性と透明性を確保するため、外資系製薬企業の権利と責任を法律に明記する。
製造施設、輸出入施設、医薬品および医薬原料卸売施設が、多数の医療施設、薬物リハビリテーション施設、試験施設、研究および研修施設、およびその他の多数の施設に直接販売する権利を拡大します。診療施設における患者の特別な治療ニーズに応えるため、診療施設が医薬品を輸入することを許可する。
医薬品及び医薬品原料流通登録に関する行政手続き改革を推進し、医薬品及び医薬品原料を薬物の性質及び流通の程度に応じて分類し、それに応じて医薬品及び医薬品原料流通登録証の交付、延長、変更、補充に関する記録、手続き、期限を調整することにより、国民が医薬品を早期に利用できる能力を高めるとともに、医薬品の国家管理、品質管理、安全性及び有効性の有効性を確保する。重複した回覧登録番号の発行を制限する規則を補足します。同時に、国防、安全、自然災害、大惨事、疫病などの要求を満たすために、薬品、薬品成分、薬品検査、薬品取引全般の登録に関する記録と手続きについて具体的な規制があります。
医薬品情報の内容を確認する手続きを廃止する。地方分権、権限委譲を強化し、管理分野における品質違反医薬品の回収と迅速な処理における保健省の役割を促進し、医薬品の安全で効果的な使用を確保する。
価格法に基づいて価格管理措置を規定し、医薬品の価格管理における具体的な措置として、処方薬に適用される予想卸売価格を公表および再公表し、中間段階を通じた医薬品の卸売価格が公表された予想卸売価格を超えないようにすることとする。
VNA
[広告2]
出典: https://baohanam.com.vn/chinh-tri/nguoi-dai-bieu-nhan-dan/quoc-hoi-chinh-thuc-thong-qua-luat-duoc-sua-doi-140545.html



![[写真] ベトナム卓球のトップ大会に向けて準備万端](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/18/9c547c497c5a4ade8f98c8e7d44f5a41)

![[写真] 党と国家の指導者が特別芸術プログラム「あなたはホーチミンです」に出席](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/18/6895913f94fd4c51aa4564ab14c3f250)



















































































コメント (0)