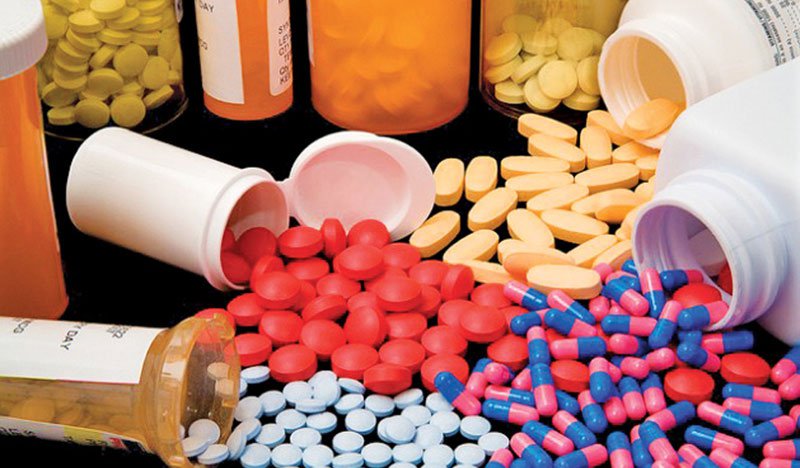
ກະ ຊວງສາທາລະນະສຸກ ຫວຽດນາມ ໄດ້ຕົກລົງຍົກເລີກໃບທະບຽນການແຜ່ລະບາດຂອງຢາຢູ່ຫວຽດນາມ ສຳລັບ 13 ຊະນິດຂອງຢາ, ເນື່ອງຈາກສະຖານທີ່ຂຶ້ນທະບຽນຢາສະໝັກໃຈຂໍຖອນໃບທະບຽນການແຜ່ລະບາດຂອງຢາ.
ຮູບປະກອບ. (ທີ່ມາ: ອິນເຕີເນັດ)
ຕາມນັ້ນແລ້ວ, ໃບຢັ້ງຢືນການແຜ່ກະຈາຍຢາເສບຕິດຢູ່ຫວຽດນາມ ຖືກຍົກເລີກຢາເສບຕິດ 13 ປະເພດຄື:
Tetraspan 6% solution for infusion, intravenous infusion dosage form, ເລກທະບຽນ: VN-18497-14, ແມ່ນລົງທະບຽນໂດຍ B. Braun Medical Industries Sdn. Bhd. (ທີ່ຢູ່: Bayan Lepas Free Industrial Zone, 11900 Bayan Lepas, Pulau Pinang, Malaysia). Spiolto Respimat, inhalation solution dosage form, ເລກທະບຽນ VN3-361-21, ແມ່ນລົງທະບຽນໂດຍ Boehringer Ingelheim International GmbH (ທີ່ຢູ່: Binger Strasse 173, 55216 Ingelheim am Rhein, ເຢຍລະມັນ). Tamiflu, ຮູບແບບປະລິມານຢາແຄບຊູນແຂງ, ໝາຍເລກທະບຽນ VN-18299-14, ແມ່ນລົງທະບຽນໂດຍ F.Hoffmann-La Roche Ltd. (ທີ່ຢູ່: 124 Grenzacherstrasse, CH-4070 Basel, Switzerland).
MS Contin 10mg, ສູດຢາເມັດຂະຫຍາຍອອກ, ເລກທະບຽນ VN-21318-18; MS Contin 30mg, ສູດຢາເມັດຂະຫຍາຍອອກ, ເລກທະບຽນ VN-21319-18; Norspan 10mcg/h, ສູດການປັບປ່ຽນຜິວໜັງ, ໝາຍເລກທະບຽນ VN3-266-20; Norspan 20mcg/h, ສູດການປັບປ່ຽນຜິວໜັງ, ໝາຍເລກທະບຽນ VN3-267-20; Norspan 5mcg/h, ສູດຢາປົວແປງຜິວໜັງ, ໝາຍເລກທະບຽນ VN3-268-20, ທັງໝົດແມ່ນລົງທະບຽນໂດຍ Mundipharma Pharmaceuticals Pte. Ltd (ທີ່ຢູ່: 12 Marina View, #22-01 Asia Square Tower 2, Singapore 018961, Singapore).
Vinorelbine "Ebewe", ຮູບແບບປະລິມານຢາແມ່ນການແກ້ໄຂເຂັ້ມຂຸ້ນສໍາລັບ້ໍາຕົ້ມ, ເລກທະບຽນ VN-20829-17; Calciumfolinate "Ebewe", ຮູບແບບປະລິມານຢາແມ່ນການແກ້ໄຂ infusion, ເລກທະບຽນ VN-23089-22; Calciumfolinate "Ebewe", ຮູບແບບປະລິມານຢາແມ່ນການແກ້ໄຂການ້ໍາຕົ້ມ, ເລກທະບຽນ VN-23090-22; Gliclazide Sandoz 30mg, ຮູບແບບປະລິມານຢາແມ່ນການແກ້ໄຂ - ປ່ອຍເມັດ, ເລກທະບຽນ VN-23041-22; Amoxicillin 250mg, dosage form is dispersible tablet, ໝາຍເລກທະບຽນ VN-22180-19, ທັງໝົດລົງທະບຽນໂດຍ Novartis (Singapore) Pte Ltd (ທີ່ຢູ່: 10 Collyer Quay, #10-01, Ocean Financial Center Singapore (049315), Singapore).
ຕາມການຕົກລົງຂອງກົມຢາເສບຕິດ, ຢາເສບຕິດຕ່າງປະເທດທີ່ນຳເຂົ້າຫວຽດນາມກ່ອນວັນທີ 21 ມິຖຸນາແມ່ນອະນຸຍາດໃຫ້ຈຳໜ່າຍຈົນເຖິງວັນໝົດອາຍຸຂອງຢາ. ສະຖານທີ່ຂຶ້ນທະບຽນຢາ ແລະ ຜະລິດຢາຕ້ອງມີຄວາມຮັບຜິດຊອບໃນການຕິດຕາມ ແລະ ຮັບຜິດຊອບຕໍ່ຄຸນນະພາບ, ຄວາມປອດໄພ ແລະ ປະສິດທິຜົນຂອງຢາໃນໄລຍະການແຜ່ລະບາດຂອງຢາ.
ການຕັດສິນໃຈນີ້ມີຜົນສັກສິດນັບແຕ່ວັນລົງນາມແລະປະກາດໃຊ້ (21 ມິຖຸນາ 2023).
TS
ທີ່ມາ




![[ຮູບພາບ] 60 ປີແຫ່ງວັນສ້າງຕັ້ງສະມາຄົມນັກສິລະປິນຫວຽດນາມ](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)

![[ຮູບພາບ] ທ່ານປະທານສະພາແຫ່ງຊາດ ເຈີ່ນດ້າຍກວາງ ເຂົ້າຮ່ວມພິທີມອບລາງວັນ VinFuture 2025](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)


























![[E-Magazine]: ສຽງຂອງອາລຸນ](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/12/05/1764941867640_e-magazine-than-w1200t0-di2548d199d5160111t11920l1-tabm-024.webp)













































































(0)