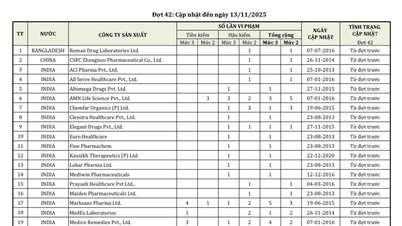
Van de bijna 600 farmaceutische producten, farmaceutische ingrediënten en geneesmiddelen met bewezen bio-equivalentie die nieuw zijn verleend of waarvan de registratie- en circulatiecertificaten door de Vietnamese geneesmiddelenadministratie zijn verlengd, kregen dit keer 404 binnenlands geproduceerde farmaceutische producten een nieuw circulatieregistratiecertificaat; 42 binnenlands geproduceerde geneesmiddelen kregen een circulatieregistratiecertificaat verlengd, waarvan 26 geneesmiddelen en farmaceutische ingrediënten voor 5 jaar werden verlengd en 14 geneesmiddelen en farmaceutische ingrediënten voor 3 jaar.
Daarnaast werden 98 geneesmiddelen met bewezen bio-equivalentie aangekondigd.
De Vietnamese geneesmiddelenadministratie eist dat farmaceutische bedrijven voldoen aan de bij het Ministerie van Volksgezondheid geregistreerde gegevens en documenten. Ook moeten ze het registratienummer dat door het Vietnamese Ministerie van Volksgezondheid is uitgegeven, op het etiket van het geneesmiddel vermelden of afdrukken.
Voldoe volledig aan de Vietnamese wetten en voorschriften van het Ministerie van Volksgezondheid inzake de productie en distributie van geneesmiddelen in Vietnam.

Het Ministerie van Volksgezondheid heeft bijna 600 nieuwe medicijnen uitgegeven en verlengd, waaronder tientallen bio-equivalente medicijnen...
Tegelijkertijd moeten productiefaciliteiten voor geneesmiddelen de bedrijfsomstandigheden van de productiefaciliteit garanderen tijdens de geldigheidsperiode van het registratiecertificaat voor de circulatie van het geneesmiddel en de ingrediënten daarvan.
Werk samen met behandelcentra om te voldoen aan de huidige regelgeving omtrent receptgeneesmiddelen, controleer de veiligheid, effectiviteit en bijwerkingen van geneesmiddelen op Vietnamese burgers en stel geneesmiddelen samen en rapporteer deze volgens de regelgeving.
Met name voor geneesmiddelen waarvan het certificaat van registratie voor het verkeer is verlengd, maar waarvoor de aanvraag voor actualisering van het etiket en de gebruiksaanwijzing niet is ingediend zoals voorgeschreven, vereist de afdeling Geneesmiddelenadministratie een actualisering zoals voorgeschreven in punt b, clausule 1, artikel 37 van circulaire nr. 01/2018/TTBYT binnen 12 maanden vanaf de datum van verlenging van het certificaat van registratie voor het verkeer.
Bovendien moeten instellingen die geneesmiddelen registreren, ervoor zorgen dat de bedrijfsomstandigheden tijdens de geldigheidsperiode van het registratiecertificaat voor het circuleren van geneesmiddelen en werkzame bestanddelen van geneesmiddelen gehandhaafd blijven.
Het is bekend dat binnenlands geproduceerde farmaceutische producten en farmaceutische ingrediënten waarvoor onlangs een registratie is verleend of waarvan de registratie dit keer is verlengd, qua farmacologische effecten behoorlijk uiteenlopen. Voorbeelden hiervan zijn geneesmiddelen voor de behandeling van infecties van de luchtwegen; geneesmiddelen voor de behandeling van artrose...; geneesmiddelen voor de behandeling van hart- en vaatziekten, hoge bloeddruk, diabetes, kankerbehandeling, antivirale geneesmiddelen, antibiotica, pijnstillers, ontstekingsremmende geneesmiddelen... Daarnaast zijn er ook geneesmiddelen waarvan de bio-equivalentie is bewezen, qua typen divers.
Bron: https://suckhoedoisong.vn/bo-y-te-cap-moi-gia-han-gan-600-thuoc-trong-do-co-hang-chuc-thuoc-tuong-duong-biological-nutrition-169251206123916227.htm


![[Foto] 60-jarig jubileum van de oprichting van de Vietnamese Vereniging van Fotografische Kunstenaars](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)


![[Foto] Voorzitter van de Nationale Assemblee, Tran Thanh Man, woont de VinFuture 2025 Award Ceremony bij](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)



































































































Reactie (0)