Les résultats ont été annoncés lors de la plus grande réunion annuelle d'experts en cancérologie, organisée par l'American Society of Clinical Oncology (ASCO) à Chicago, aux États-Unis. Le cancer du poumon est la forme la plus mortelle de la maladie, avec environ 1,8 million de décès chaque année dans le monde .
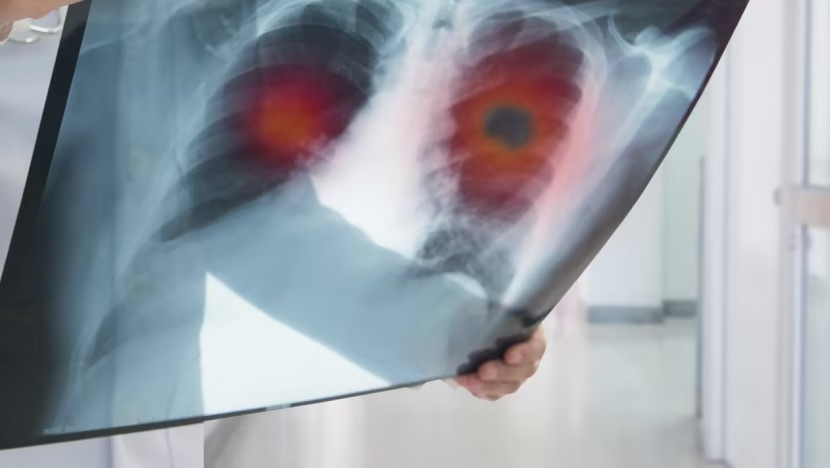
Un médecin examine une radiographie d'une tumeur pulmonaire. Photo : iStock
Le traitement, développé par le géant pharmaceutique AstraZeneca, s'appelle osimertinib et est commercialisé sous le nom de Tagrisso. Il cible un type de cancer du poumon chez les patients atteints de cancer du poumon non à petites cellules et présente une mutation spécifique.
Il s'agit du type de cancer du poumon le plus fréquent. Ces mutations touchent 10 à 25 % des patients atteints de cancer du poumon aux États-Unis et en Europe, et jusqu'à 30 à 40 % en Asie.
L'essai clinique a porté sur 680 participants atteints d'une maladie à un stade précoce (stades 1b à 3a) dans plus de 20 pays. Ils ont d'abord subi une intervention chirurgicale pour retirer la tumeur, puis la moitié des patients ont reçu un traitement quotidien et les autres un placebo (médicaments sans effet thérapeutique).
Les résultats ont montré que le risque de décès était 51 % inférieur chez les patients prenant le médicament par rapport à ceux prenant le placebo. Après cinq ans, 88 % des patients traités étaient encore en vie, contre 78 % chez les patients sous placebo.
Les données étaient « très impressionnantes », a déclaré Roy Herbst, de l'Université Yale, qui a présenté les résultats de l'essai à Chicago. Il a ajouté lors d'une conférence de presse que le médicament « empêchait le cancer de se propager au cerveau, au foie et aux os ».
L'osimertinib a été autorisé dans des dizaines de pays pour diverses indications et a été administré à environ 700 000 personnes, selon un communiqué de presse d'AstraZeneca.
Herbst a déclaré que tous les médecins n'utilisaient pas le traitement et que beaucoup attendaient que les données de survie globale soient publiées dimanche.
Mai Van (selon AFP, CNA)
Source





































































































Comment (0)