De afgelopen jaren is er een grote verschuiving in ons begrip van kanker geweest: het besef dat micro-organismen niet alleen in de darmen voorkomen, maar ook in tumorweefsel – waaronder solide tumoren zoals borst-, prostaat- en longtumoren. Deze microbiële gemeenschappen (gezamenlijk het intratumorale microbioom of tumorgeassocieerd microbioom genoemd) interacteren rechtstreeks met kankercellen, immuuncellen en de omgeving, en beïnvloeden zo de tumorbiologie, de respons op behandelingen en de prognose.
Is de microbiota in tumorweefsel anders dan de darmmicrobiota?
Tumorweefsel werd voorheen beschouwd als een "steriele zone", maar recente genomische en sequentieanalyses hebben microbieel DNA/RNA in veel gereseceerde tumorspecimens aan het licht gebracht. Deze microben kunnen zich bevinden in kankercellen, in immuuncellen of in het omringende bindweefsel. De samenstelling en dichtheid van microben variëren per tumortype en patiënt – borsttumoren hebben bijvoorbeeld een relatief hoge microbiële diversiteit in vergelijking met sommige andere tumoren – en hun locatie (intracellulair versus extracellulair) bepaalt hoe ze ziek weefsel beïnvloeden.
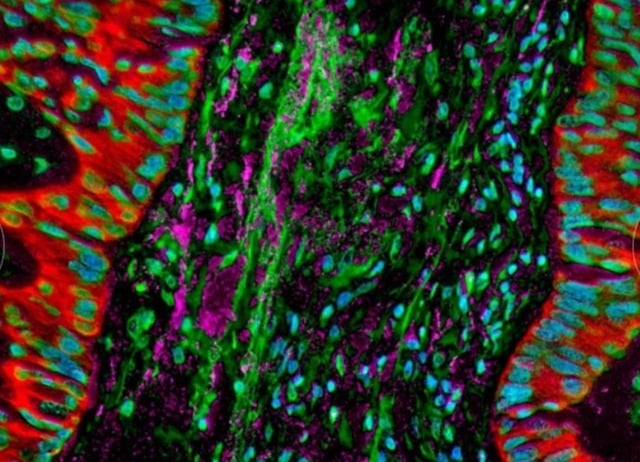
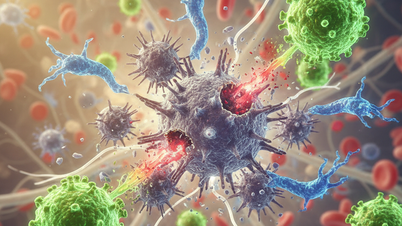
Microscopische beelden laten zien dat bacteriën zich in longkankercellen bevinden en de immuunreactie van het lichaam verstoren.
De rol van bacteriën en virussen in borst-, prostaat- en longweefsel
Lokale microbiota kunnen de immuunomgeving zowel onderdrukkend als activerend beïnvloeden. Sommige microben triggeren chronische ontstekingssignalen (bijvoorbeeld via patroonherkenningsreceptoren zoals TLR's), wat leidt tot een toename van pro-inflammatoire cytokinen, die onderdrukkende immuuncellen (M2-macrofagen, Treg's) aantrekken – en zo tumoren helpen om aan immuniteit te ontsnappen. Omgekeerd kunnen sommige bacteriën of virussen de cellulaire immuniteit stimuleren (verhoogde antigeenpresentatie, activering van CD8+ T-cellen) en bijdragen aan de effectiviteit van immunotherapie. Zo kan dezelfde microbiota, afhankelijk van de context, een 'vriend' of een 'vijand' zijn.
Sommige bacteriën produceren toxines of stoffen die DNA beschadigen, mutaties veroorzaken en de progressie van kanker bevorderen. Omgekeerd kunnen andere microben een metabolisme induceren dat de groei van tumorcellen remt. Studies in borstweefsel hebben de aanwezigheid van bacteriën aangetoond die betrokken zijn bij ontstekings- en metabole processen; in de prostaat worden microbiële veranderingen geassocieerd met ziekteprogressie en de respons op anti-androgeentherapie; en in de longen kan het endogene microbioom interacteren met door roken veroorzaakte ontstekingen en de micro-omgeving veranderen, waardoor tumoren minder goed reageren op immunotherapie.
De aanwezigheid of samenstelling van het intratumorale microbioom kan de effectiviteit van chemotherapie, radiotherapie en met name immunotherapie beïnvloeden. Mechanismen omvatten veranderingen in de micro-omgeving (pH, voeding), lokale inactivatie van geneesmiddelen (sommige bacteriën bezitten geneesmiddelafbrekende enzymen) of modulatie van antigeenpresentatie en infiltratie van immuuncellen. Verschillende studies hebben aangetoond dat verschillen in tumormicrobiota verband houden met de respons op of resistentie tegen immuuncheckpointremmers (ICI's).
Lokale modificatie van het microbioom in tumorweefsel: bestaande en onderzoeksstrategieën
Het idee om direct in te grijpen in het tumormicrobioom opent nieuwe behandelmogelijkheden. Enkele van de benaderingen die zijn of worden ontwikkeld, zijn:
In sommige experimentele modellen heeft het gebruik van antibiotica om 'slechte' soorten in tumoren te elimineren de weefselreacties op de medicijnen veranderd. Systemische antibiotica hebben echter wijdverspreide effecten (en kunnen het darmmicrobioom verstoren dat nodig is voor immuniteit), dus lokaal antibioticagebruik of de ontwikkeling van antibiotica die selectief zijn voor de doelsoorten heeft prioriteit.
Het idee is om gemanipuleerde bacteriën in tumorweefsel te introduceren die immuunstimulerende cytokines, metabolische enzymen die de pH veranderen, of enzymen die immunosuppressiva afbreken, afscheiden. Sommige preklinische studies met verzwakte bacteriën om medicijnen lokaal af te geven, hebben veelbelovende resultaten opgeleverd.
Er is onderzoek gedaan naar oncolytische virussen die kankercellen direct doden en tegelijkertijd de antitumorimmuniteit stimuleren. De combinatie van oncolytische virussen met microbioombewerking zou de lokale T-celactivatie kunnen versterken en de systemische respons kunnen versterken.
Hoewel het hier om lokale microbiologie gaat, is het belangrijk om op te merken dat er een darm-tumor-as bestaat: veranderingen in het darmmicrobioom (bijvoorbeeld door voeding, probiotica, FMT) kunnen indirect het intratumorale microbioom en de systemische immuniteit veranderen en zo het tumorweefsel in de longen, borst of prostaat beïnvloeden.

Wetenschappers analyseren microbieel DNA in tumorweefsel om soorten te vinden die de effectiviteit van kankerbehandelingen beïnvloeden.
Klinische uitdagingen en overwegingen
- Onderscheid maken tussen 'oorzaak' en 'gevolg': veel recente onderzoeken beschrijven nog steeds correlaties, maar hebben geen causaal verband kunnen bevestigen tussen microbiologie en tumorgroei.
- Technische standaardisatie: bemonstering, DNA/RNA-isolatie, het vermijden van externe contaminatie en bioinformatica-analyse vereisen allemaal standaardisatie om betrouwbare resultaten te kunnen behalen.
- Grote variabiliteit tussen patiënten: het microbioom is individueel afhankelijk, interventies moeten individueel worden afgestemd.
- Veiligheid: Het inbrengen van levende bacteriën of virussen in tumorweefsel brengt het risico van infectie of een overreactie van het immuunsysteem met zich mee. Deze therapieën vereisen strenge testen.
De studie van het tumor-geassocieerde microbioom opent een nieuwe laag in de biologie van de oncologie: het lokale microbioom kan zowel een kankerbevorderaar zijn als een instrument voor immuunmodulatie en gerichte medicijnafgifte aan tumoren. Dankzij vooruitgang in sequencing, histologie, biomimicry en microbioom-engineeringtechnieken belooft de nabije toekomst dat therapeutische strategieën die zich richten op of gebruikmaken van het lokale microbioom – van bio-engineering bacteriën en selectieve fagen tot immunocompetente oncolytische virussen – onderdeel zullen worden van multimodale therapie.
Het klinische traject is echter nog lang. Voordat deze interventies op grote schaal worden toegepast, zijn standaardisatie van testen, het aantonen van causaliteit en het garanderen van de veiligheid een vereiste.
Bron: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm







































































































Reactie (0)