W ostatnich latach istotnym przełomem w naszym rozumieniu raka było uświadomienie sobie, że mikroorganizmy bytują nie tylko w jelitach, ale także w tkance nowotworowej – w tym w guzach litych, takich jak guz piersi, prostaty i płuc. Te społeczności mikroorganizmów (zwane zbiorczo mikrobiomem wewnątrzguzowym lub mikrobiomem towarzyszącym guzowi) oddziałują bezpośrednio z komórkami nowotworowymi, komórkami układu odpornościowego i otaczającym środowiskiem, wpływając w ten sposób na biologię guza, odpowiedź na leczenie i rokowanie.
Czy mikrobiota w tkance nowotworowej różni się od mikrobioty jelitowej?
Tkanka guza była wcześniej uważana za „strefę sterylną”, ale niedawna analiza genomiczna i sekwencjonowanie ujawniły obecność DNA/RNA drobnoustrojów w wielu wyciętych próbkach guza. Drobnoustroje te mogą znajdować się w komórkach nowotworowych, w komórkach układu odpornościowego lub w otaczającej tkance łącznej. Skład i gęstość drobnoustrojów różnią się w zależności od rodzaju guza i pacjenta – na przykład guzy piersi charakteryzują się stosunkowo dużą różnorodnością mikroorganizmów w porównaniu z niektórymi innymi guzami – a ich lokalizacja (wewnątrzkomórkowa vs. zewnątrzkomórkowa) decyduje o tym, jak wpływają na chorą tkankę.
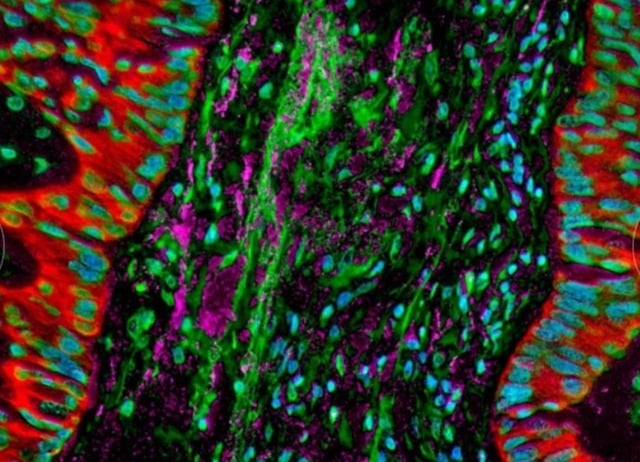
Zdjęcia mikroskopowe ukazują bakterie bytujące w komórkach raka płuc, które zmieniają odpowiedź immunologiczną organizmu.
Rola bakterii i wirusów w tkance piersi, prostaty i płuc
Lokalna mikrobiota może modulować środowisko immunologiczne w sposób supresyjny lub aktywujący. Niektóre mikroorganizmy wyzwalają przewlekłe sygnały zapalne (np. za pośrednictwem receptorów rozpoznających wzorce, takich jak TLR), co prowadzi do wzrostu stężenia cytokin prozapalnych, które przyciągają supresyjne komórki odpornościowe (makrofagi M2, limfocyty Treg) – pomagając w ten sposób guzom unikać odpowiedzi immunologicznej. Z drugiej strony, niektóre bakterie lub wirusy mogą stymulować odporność komórkową (zwiększona prezentacja antygenu, aktywacja limfocytów T CD8+) i przyczyniać się do skuteczności immunoterapii. Zatem ta sama mikrobiota może być „przyjacielem” lub „wrogiem”, w zależności od kontekstu.
Niektóre bakterie wytwarzają toksyny lub związki uszkadzające DNA, powodując mutacje i sprzyjając rozwojowi raka. Z kolei inne mikroorganizmy mogą indukować metabolizm, który hamuje wzrost komórek nowotworowych. Badania wykazały obecność bakterii zaangażowanych w szlaki zapalne i metaboliczne w tkance piersi; w prostacie zmiany mikrobiologiczne są związane z postępem choroby i odpowiedzią na terapię antyandrogenową; a w płucach endogenny mikrobiom może oddziaływać na stan zapalny wywołany paleniem tytoniu i modyfikować mikrośrodowisko, zmniejszając wrażliwość guzów na immunoterapię.
Obecność lub skład mikrobiomu wewnątrzguzowego może wpływać na skuteczność chemioterapii, radioterapii, a zwłaszcza immunoterapii. Mechanizmy te obejmują zmiany mikrośrodowiska (pH, odżywianie), miejscową inaktywację leków (niektóre bakterie posiadają enzymy degradujące leki) lub modulację prezentacji antygenu i infiltracji komórek układu odpornościowego. Kilka badań wykazało, że różnice w mikrobiomie guza są związane z odpowiedzią lub opornością na inhibitory punktów kontrolnych układu odpornościowego (ICI).
Lokalna modyfikacja mikrobiomu w tkance nowotworowej — strategie istniejące i badawcze
Koncepcja bezpośredniej ingerencji w mikrobiom guza otwiera nowe możliwości leczenia. Niektóre z opracowywanych lub będących w fazie rozwoju podejść obejmują:
W niektórych modelach eksperymentalnych stosowanie antybiotyków w celu wyeliminowania „złych” gatunków w guzach zmieniało odpowiedź tkanek na leki. Jednak antybiotyki ogólnoustrojowe mają szerokie spektrum działania (i mogą zaburzać mikrobiom jelitowy niezbędny dla odporności), dlatego priorytetem jest miejscowe stosowanie antybiotyków lub opracowanie antybiotyków selektywnych dla gatunków docelowych.
Pomysł polega na wprowadzeniu do tkanki guza zmodyfikowanych genetycznie bakterii, które wydzielają cytokiny stymulujące układ odpornościowy, enzymy metaboliczne zmieniające pH lub enzymy rozkładające leki immunosupresyjne. Niektóre badania przedkliniczne z wykorzystaniem osłabionych bakterii do miejscowego podawania leków dały obiecujące rezultaty.
Badano, czy wirusy onkolityczne bezpośrednio zabijają komórki nowotworowe i jednocześnie stymulują odporność przeciwnowotworową. Połączenie wirusów onkolitycznych z edycją mikrobiomu może wzmocnić lokalną aktywację limfocytów T i rozszerzyć odpowiedź ogólnoustrojową.
Chociaż tematem przewodnim jest mikrobiologia lokalna, należy zauważyć, że istnieje oś jelito-guz: zmiany w mikrobiomie jelitowym (np. poprzez dietę, probiotyki, FMT) mogą pośrednio zmieniać mikrobiom wewnątrzguzowy i odporność ogólnoustrojową, wpływając w ten sposób na tkankę nowotworową w płucach, piersi lub prostacie.

Naukowcy analizują DNA drobnoustrojów w tkance nowotworowej w celu znalezienia gatunków, które mają wpływ na skuteczność leczenia raka.
Wyzwania kliniczne i rozważania
- Rozróżnianie między „przyczyną” i „skutkiem”: wiele aktualnych badań nadal opisuje korelacje, ale nie potwierdziło związku przyczynowo-skutkowego między mikrobiologią a postępem nowotworu.
- Standaryzacja techniczna: pobieranie próbek, izolacja DNA/RNA, unikanie zanieczyszczeń zewnętrznych i analiza bioinformatyczna wymagają standaryzacji w celu uzyskania wiarygodnych wyników.
- Duża zmienność pomiędzy pacjentami: mikrobiom jest zależny od danej osoby, dlatego interwencje muszą być dostosowane do indywidualnych potrzeb.
- Bezpieczeństwo: Wprowadzenie żywych bakterii lub wirusów do tkanki nowotworowej niesie ze sobą ryzyko infekcji lub nadmiernej reakcji układu odpornościowego. Tego typu terapie wymagają rygorystycznych testów.
Badanie mikrobiomu towarzyszącego guzom otwiera nowy poziom biologii w onkologii: lokalny mikrobiom może być zarówno promotorem nowotworu, jak i narzędziem modulacji układu odpornościowego oraz ukierunkowanego dostarczania leków do guzów. Dzięki postępom w sekwencjonowaniu, histologii, biomimikrze i technikach inżynierii mikrobiomu, w niedalekiej przyszłości strategie terapeutyczne ukierunkowane na lokalny mikrobiom lub wykorzystujące go – od bakterii modyfikowanych biologicznie, przez selektywne fagi, po immunokompetentne wirusy onkolityczne – staną się częścią terapii multimodalnej.
Jednakże droga kliniczna jest jeszcze daleka; standaryzacja testów, wykazanie związku przyczynowo-skutkowego i zapewnienie bezpieczeństwa będą warunkami wstępnymi, zanim te interwencje zostaną powszechnie przyjęte.
Źródło: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm







































































































Komentarz (0)