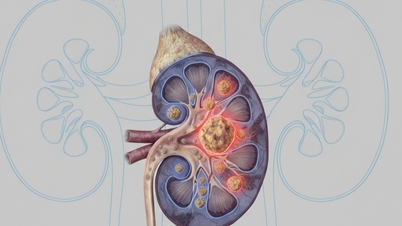
Os medicamentos acima pertencem ao grupo dos antibióticos, medicamentos para o tratamento da dislipidemia, hipertensão arterial, doenças cardiovasculares e diabetes tipo 2.
De acordo com as normas do Ministério da Saúde , os estudos de bioequivalência devem ser conduzidos em unidades de teste avaliadas e reconhecidas pelas autoridades competentes do país anfitrião, e devem ser realizados em conformidade com os princípios das boas práticas clínicas e das boas práticas de laboratório, segundo a legislação vigente. A instituição que registra os medicamentos bioequivalentes deve ser responsável por fornecer evidências completas e legalmente válidas de que a pesquisa foi realizada.

Os estudos de bioequivalência devem ser conduzidos em instalações de teste credenciadas e reconhecidas.
ILUSTRAÇÃO: PHUONG AN CRIADA POR IA
Segundo um especialista farmacêutico, um medicamento bioequivalente (biossimilar) é um medicamento que apresenta semelhanças em qualidade, segurança e eficácia clínica em comparação com um medicamento de referência, um medicamento original licenciado, e que, quando usado na mesma dose e sob as mesmas condições de teste, possui efeitos terapêuticos equivalentes.
Os medicamentos bioequivalentes ajudam a aumentar o acesso dos pacientes ao tratamento, devido aos custos mais baixos em comparação com os medicamentos de referência licenciados.
Fonte: https://thanhnien.vn/them-9-thuoc-san-xuat-trong-nuoc-co-chung-minh-tuong-duong-biological-nutrition-18525090319531865.htm




![[Foto] O Secretário-Geral To Lam recebe o Diretor da Academia de Administração Pública e Economia Nacional junto à Presidência da Federação Russa.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F08%2F1765200203892_a1-bnd-0933-4198-jpg.webp&w=3840&q=75)









































































































Comentário (0)