В последние годы важным сдвигом в нашем понимании рака стало осознание того, что микроорганизмы обитают не только в кишечнике, но и в опухолевой ткани, включая солидные опухоли, такие как рак молочной железы, предстательной железы и лёгких. Эти микробные сообщества (совместно называемые интратуморальным или опухоль-ассоциированным микробиомом) напрямую взаимодействуют с раковыми клетками, иммунными клетками и окружающей средой, тем самым влияя на биологию опухоли, ответ на лечение и прогноз.
Отличается ли микробиота опухолевой ткани от микробиоты кишечника?
Ранее опухолевая ткань считалась «стерильной зоной», но недавний геномный анализ и секвенирование выявили наличие микробной ДНК/РНК во многих образцах резецированных опухолей. Эти микробы могут находиться внутри раковых клеток, внутри иммунных клеток или быть внедренными в окружающую соединительную ткань. Состав и плотность микробов различаются в зависимости от типа опухоли и пациента (например, опухоли молочной железы характеризуются относительно высоким микробным разнообразием по сравнению с некоторыми другими опухолями), а их расположение (внутриклеточное или внеклеточное) определяет характер их воздействия на пораженную ткань.
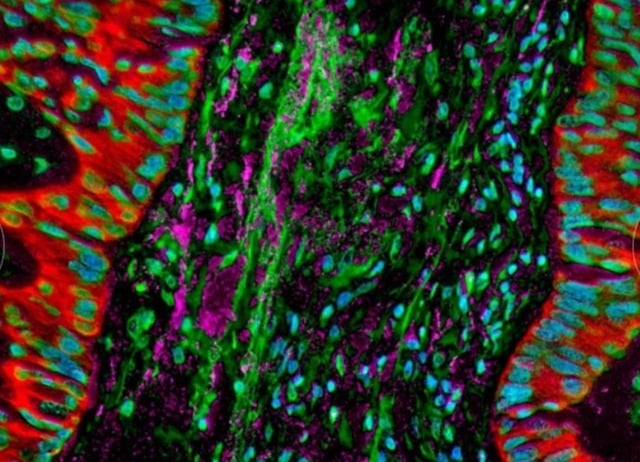
Микроскопические изображения показывают бактерии, находящиеся в клетках рака легких, которые изменяют иммунный ответ организма.
Роль бактерий и вирусов в тканях молочной железы, предстательной железы и легких
Локальная микробиота может модулировать иммунную среду как подавляющим, так и активирующим образом. Некоторые микробы запускают хронические воспалительные сигналы (например, через паттерн-распознающие рецепторы, такие как TLR), что приводит к повышению уровня провоспалительных цитокинов, которые привлекают супрессорные иммунные клетки (макрофаги M2, Treg), тем самым помогая опухолям ускользать от иммунитета. Напротив, некоторые бактерии или вирусы могут стимулировать клеточный иммунитет (усиление презентации антигенов, активация CD8+ T-лимфоцитов) и способствовать эффективности иммунотерапии. Таким образом, одна и та же микробиота может быть «другом» или «врагом» в зависимости от контекста.
Некоторые бактерии производят токсины или соединения, повреждающие ДНК, вызывая мутации и способствуя прогрессированию рака. Другие микробы, напротив, могут индуцировать метаболизм, замедляющий рост опухолевых клеток. Исследования в тканях молочной железы выявили наличие бактерий, участвующих в воспалительных и метаболических процессах; в предстательной железе изменения микробного состава связаны с прогрессированием заболевания и ответом на антиандрогенную терапию; а в лёгких эндогенный микробиом может взаимодействовать с воспалением, вызванным курением, и изменять микросреду, снижая чувствительность опухолей к иммунотерапии.
Наличие или состав интратуморального микробиома может влиять на эффективность химиотерапии, лучевой терапии и, особенно, иммунотерапии. Механизмы включают изменения микросреды (pH, питание), локальную инактивацию лекарств (некоторые бактерии обладают ферментами, разрушающими лекарства) или модуляцию презентации антигенов и инфильтрации иммунных клеток. Несколько исследований показали, что различия в опухолевой микробиоте связаны с ответом или резистентностью к ингибиторам контрольных точек иммунного ответа (ИКТ).
Локальная модификация микробиома в опухолевой ткани — существующие и исследуемые стратегии
Идея прямого воздействия на микробиом опухоли открывает новые возможности лечения. Среди уже разработанных и разрабатываемых подходов можно назвать следующие:
В некоторых экспериментальных моделях применение антибиотиков для уничтожения «вредных» видов микроорганизмов в опухолях приводило к изменению реакции тканей на препараты. Однако системные антибиотики оказывают широкое действие (и могут нарушить микробиом кишечника, необходимый для иммунитета), поэтому приоритетом является локальное применение антибиотиков или разработка антибиотиков, селективных к целевым видам микроорганизмов.
Идея заключается во введении в опухолевую ткань модифицированных бактерий, которые секретируют иммуностимулирующие цитокины, метаболические ферменты, изменяющие pH, или ферменты, расщепляющие иммунодепрессанты. Некоторые доклинические исследования с использованием ослабленных бактерий для локальной доставки лекарств показали многообещающие результаты.
Было изучено, что онколитические вирусы напрямую убивают раковые клетки и одновременно стимулируют противоопухолевый иммунитет. Сочетание онколитических вирусов с редактированием микробиома может усилить локальную активацию Т-клеток и расширить системный ответ.
Хотя здесь обсуждается локальная микробиология, важно отметить, что существует ось «кишечник-опухоль»: изменения в микробиоме кишечника (например, через диету, пробиотики, FMT) могут косвенно изменять внутриопухолевый микробиом и системный иммунитет, тем самым влияя на опухолевую ткань в легких, молочной железе или предстательной железе.

Ученые анализируют микробную ДНК в опухолевой ткани, чтобы найти виды, влияющие на эффективность лечения рака.
Клинические проблемы и соображения
- Различение «причины» и «следствия»: многие современные исследования по-прежнему описывают корреляции, но не подтверждают причинно-следственную связь между микробиологией и прогрессированием опухолей.
- Техническая стандартизация: отбор проб, выделение ДНК/РНК, предотвращение экзогенного загрязнения и биоинформатический анализ — все это требует стандартизации для получения надежных результатов.
- Высокая вариабельность между пациентами: микробиом индивидуален, вмешательства должны быть индивидуальными.
- Безопасность: Введение живых бактерий или вирусов в опухолевую ткань несет риск инфицирования или чрезмерной реакции иммунной системы; такие методы лечения требуют тщательного тестирования.
Изучение опухолеассоциированного микробиома открывает новый пласт биологии в онкологии: локальный микробиом может быть как стимулятором развития рака, так и инструментом иммуномодуляции и адресной доставки лекарств к опухолям. Благодаря достижениям в области секвенирования, гистологии, биомимикрии и методов микробиомной инженерии, в ближайшем будущем терапевтические стратегии, направленные на локальный микробиом или использующие его – от биоинженерных бактерий, селективных фагов до иммунокомпетентных онколитических вирусов – станут частью мультимодальной терапии.
Однако клинический путь еще долог: стандартизация испытаний, демонстрация причинно-следственной связи и обеспечение безопасности станут предпосылками для широкого внедрения этих вмешательств.
Источник: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm







































































































Комментарий (0)