Tidigare den 25 september meddelade Pakistans läkemedelsmyndighet (DRAP) att landets myndigheter utredde två inhemska distributörer som importerade och sålde cancerbehandlingsläkemedlet Avastin från det schweiziska företaget Roche, efter att 12 patienter som fått injektioner av läkemedlet blivit blinda.
Angående denna information uppgav Vietnams läkemedelsmyndighet att F. Hoffmann La Roche Ltd.s representationskontor den 27 september utfärdade officiell rapport nr RA/02/09/2023 med uppdaterad information om utredningen relaterad till det ovannämnda läkemedlet Avastin.
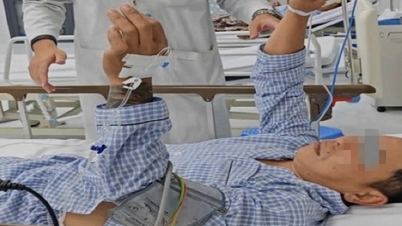
Mer specifikt i Pakistan förlorade cirka 12 patienter synen efter att ha använt injektioner från den illegala leverantören Genius Pharmaceutical Service.
Läkemedlet är märkt "Inj. Avastin 1.25mg/0.05ml" vilket kan vara vilseledande då det är en Roche-produkt. Roches Avastin är inte godkänt för något oftalmiskt bruk.
Genius Pharmaceutical Service levererade/spädde/ompaketerade läkemedlet i en dos av 1,25 mg/0,5 ml under ohygieniska och icke godkända förhållanden.
Roche informerade om att de pakistanska myndigheterna för närvarande utreder de möjliga orsakerna till infektionen, inklusive: otillräcklig sterilisering, kontaminerade injektionsflaskor, icke-sterila sprutor och brott mot standardrutiner under dispenseringsprocessen.
Samtidigt har den pakistanska regeringen begärt återkallelse av tre batcher av Avastin 100 mg/ml (H352B11, B7266B07, B7266B20) från Roche och alla läkemedel som levererats av Genius Pharmaceutical Service.
Vietnams läkemedelsmyndighet uppgav att Avastin i Vietnam fortfarande har fyra giltiga registreringscertifikat för cirkulation, nämligen: Bevacizumab 100 mg/4 ml (kartong med 1 flaska x 4 ml; registreringsnummer: 400410250123 (QLSP-1118-18); tillverkare: Roche Diagnostics GmbH, Tyskland); Bevacizumab 400 mg/16 ml (kartong med 1 flaska x 16 ml: registreringsnummer: 400410250223 (QLSP-1119-18); tillverkare: Roche Diagnostics GmbH, Tyskland); Bevacizumab 100 mg/4 ml (kartong med 1 flaska x 16 ml; registreringsnummer: QLSP-1010-17; tillverkare: F. Hoffmann-La Roche Ltd., Schweiz); Bevacizumab 400 mg/16 ml (kartong med 1 injektionsflaska x 16 ml; registreringsnummer: QLSP-1011-17; tillverkare: F. Hoffmann-La Roche Ltd., Schweiz).
Följaktligen beviljas Avastin ett registreringscertifikat för cirkulation i Vietnam med specifika indikationer och varningar för behandling av: metastaserande kolorektal cancer; avancerad, metastaserande eller återkommande icke-småcellig lungcancer; avancerad och/eller metastaserande njurcellscancer; glioblastom/malignt gliom (stadium IV - WHO); epitelial äggstockscancer, äggledarecancer och primär peritonealcancer.
Avastin varnas för användning för intravitreal injektion. Reaktioner kan inkludera intraokulär infektion, endoftalmit, konjunktivalblödning och andra allvarliga biverkningar. Vissa händelser har resulterat i varierande grad av synfältsförlust, inklusive permanent blindhet.
Läkemedelsverket i Vietnam informerade att läkemedelsverket i Vietnam per den 27 september 2023 inte har mottagit några rapporter som återspeglar biverkningarna av Avastin relaterade till patienter som förlorar synen efter att ha använt Avastin.
[annons_2]
Källa




![[Foto] Avslutningsceremoni för Hanois partikommittés 18:e kongress](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/17/1760704850107_ndo_br_1-jpg.webp)























![[Foto] Tidningen Nhan Dan lanserar ”Fatherland in the Heart: The Concert Film”](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/16/1760622132545_thiet-ke-chua-co-ten-36-png.webp)











































































Kommentar (0)