In der Entscheidung Nr. 4318 vom 2. Dezember der Arzneimittelbehörde von Vietnam, die an die Gesundheitsbehörden der Provinzen, Städte und Arzneimittelimportunternehmen gerichtet ist, wird erklärt, dass die Bestimmungen in Artikel 9 des Rundschreibens Nr. 30/2025/TT-BYT vom 1. Juli 2025 des Gesundheitsministeriums über die Bekanntgabe, Aktualisierung und Streichung von Namen aus der Liste der Produktionsstätten, deren Arzneimittel gegen die Qualitätsstandards verstoßen, umgesetzt werden;
Auf Grundlage der Ergebnisse der Überwachung der Qualität von im Umlauf befindlichen Arzneimitteln und der Überprüfung von Betrieben mit Arzneimitteln, die gegen die Qualitätsstandards verstoßen, sowie von ausländischen Arzneimittelherstellungsbetrieben, die von der Liste derjenigen gestrichen werden können, die verpflichtet sind, Proben für die Qualitätsprüfung von 100 % der importierten Arzneimittelchargen zu entnehmen, gibt die Arzneimittelbehörde von Vietnam die Veröffentlichung der Phase 42 bekannt - Liste der ausländischen Unternehmen mit Arzneimitteln, die gegen die Qualitätsstandards verstoßen und verpflichtet sind, Proben für die Qualitätsprüfung von 100 % der importierten Arzneimittelchargen zu entnehmen (Vorinspektion).
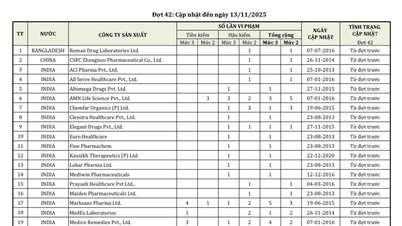
Demnach stellen indische Unternehmen weiterhin das Land mit den meisten Verstößen in dieser Liste dar. Eine Reihe von Unternehmen, die zwischen 2013 und 2015 aufgetaucht sind, befinden sich weiterhin in der Vorprüfung.

Liste von 46 ausländischen Pharmaunternehmen, deren Arzneimittel gegen Qualitätsstandards verstoßen (Stand: 13. November 2025). Screenshot der Website der vietnamesischen Arzneimittelbehörde.
Neben dem großen Konzern aus Indien stehen auch zahlreiche Unternehmen aus Bangladesch, China, Indonesien, Südkorea, Pakistan, den USA, Italien und Rumänien weiterhin unter besonderer Aufsicht. Reman Drug Laboratories aus Bangladesch, CSPC Zhongnuo aus China, PT. Merck Tbk aus Indonesien sowie Crown Pharm und Yuyu Inc. aus Südkorea wurden bereits frühzeitig wegen Verstößen gegen die Vorschriften gemeldet, erfüllen aber noch nicht die Voraussetzungen für die Aufhebung der Vorinspektionsmaßnahmen.
Auf dieser Liste befinden sich zwei amerikanische Unternehmen, nämlich ADH Health Products und Robinson Pharma, bei denen sowohl vor als auch nach der Inspektion Qualitätsverstöße festgestellt wurden.
Gemeinsames Merkmal aller 46 Unternehmen ist, dass sie alle Medikamente nach Vietnam importiert haben, die nicht den Qualitätsstandards entsprechen, weshalb die Produkte vor dem Inverkehrbringen streng überwacht werden müssen.
Zusätzlich zur Liste der Verstöße teilte die Arzneimittelbehörde mit, dass 98 Unternehmen aus 16 Ländern nach Abschluss der Vorinspektionsphase von der Überwachungsliste gestrichen wurden, da keine neuen Verstöße aufgetreten waren.
Die Arzneimittelbehörde Vietnams ersucht die Gesundheitsbehörden der Provinzen, Städte und Gesundheitssektoren, die ihnen unterstehenden Einheiten für Arzneimittelmanagement, -inspektion und -prüfung anzuweisen, Inspektionen und Überwachungen der Einhaltung der Vorschriften zur Qualitätsprüfung importierter Arzneimittel im Umlauf im Zuständigkeitsbereich durchzuführen und gegen Organisationen/Einzelpersonen vorzugehen, die gegen die geltenden Vorschriften verstoßen.
Quelle: https://suckhoedoisong.vn/bo-y-te-cong-bo-danh-sach-46-cong-ty-duoc-nuoc-ngoai-co-thuoc-vi-pham-chat-luong-169251203151356603.htm












































































































Kommentar (0)