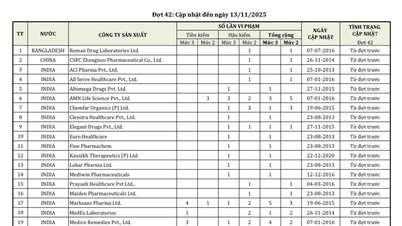
Соответственно, среди почти 600 фармацевтических продуктов, фармацевтических ингредиентов и препаратов с доказанной биоэквивалентностью, которым Управление по контролю за лекарственными средствами Вьетнама в этот раз выдало или продлило их регистрационные удостоверения и свидетельства о праве на обращение, 404 фармацевтических продукта отечественного производства получили новые свидетельства о праве на обращение; 42 лекарственным препаратам отечественного производства были продлены их свидетельства о праве на обращение, из которых 26 лекарственных препаратов и фармацевтических ингредиентов были продлены на 5 лет, а 14 лекарственных препаратов и фармацевтических ингредиентов — на 3 года.
Наряду с этим было заявлено 98 препаратов с доказанной биоэквивалентностью.
Управление по контролю за лекарственными средствами Вьетнама требует от компаний-производителей лекарственных препаратов соблюдать записи и документы, зарегистрированные в Министерстве здравоохранения, а также печатать или наносить на этикетку лекарственного препарата регистрационный номер, выданный Министерством здравоохранения Вьетнама.
Полностью соблюдать вьетнамские законы и постановления Министерства здравоохранения по производству и обороту лекарственных средств во Вьетнаме.

Министерство здравоохранения выдало и продлило регистрацию почти 600 лекарственных препаратов, в том числе десятки биоэквивалентных препаратов...
При этом предприятия по производству лекарственных средств обязаны обеспечить условия функционирования производственного объекта в течение срока действия регистрационного удостоверения на обращение лекарственного средства и его субстанции.
Взаимодействовать с лечебными учреждениями для соблюдения действующих правил в отношении рецептурных препаратов, осуществлять мониторинг безопасности, эффективности и побочных эффектов лекарств для вьетнамцев, а также синтезировать и отчитываться в соответствии с правилами.
В частности, в отношении лекарственных средств, срок действия удостоверения на регистрацию в обращении которых был продлен, но заявление на обновление инструкции по применению лекарственного средства и этикетки к нему не было подано в установленном порядке, Департамент по контролю за лекарственными средствами требует провести обновление в соответствии с подпунктом b) пункта 1 статьи 37 циркуляра № 01/2018/TTBYT в течение 12 месяцев с даты продления срока действия удостоверения на регистрацию в обращении.
Кроме того, учреждения, осуществляющие регистрацию лекарственных средств, обязаны обеспечить поддержание условий ведения деятельности в течение срока действия удостоверения о регистрации обращения лекарственного средства и его субстанции.
Известно, что отечественные фармацевтические продукты и фармацевтические субстанции, регистрация которых была впервые получена или возобновлена на этот раз, весьма разнообразны по фармакологическому действию, например, препараты для лечения инфекций дыхательных путей; препараты для лечения остеоартрита...; препараты для лечения сердечно-сосудистых заболеваний, повышенного артериального давления, диабета, лечения рака, противовирусные препараты, антибиотики, обезболивающие, противовоспалительные препараты... Наряду с этим препараты с доказанной биоэквивалентностью также разнообразны по видам.
Источник: https://suckhoedoisong.vn/bo-y-te-cap-moi-gia-han-gan-600-thuoc-trong-do-co-hang-chuc-thuoc-tuong-duong-biological-nutrition-169251206123916227.htm


![[Фото] 60-я годовщина основания Вьетнамской ассоциации фотохудожников](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)

![[Фото] Председатель Национальной ассамблеи Чан Тхань Ман присутствует на церемонии вручения премии VinFuture 2025](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)




































































































Комментарий (0)