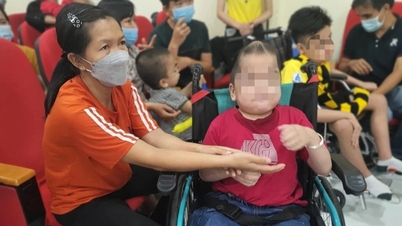
Генна терапія для людей з рідкісним захворюванням СМА віком від 2 років
28 листопада доктор До Фуок Хюй, засновник В'єтнамської організації рідкісних захворювань (VORD), повідомив репортеру Дена Трі , що Управління з контролю за продуктами харчування та лікарськими засобами США (FDA) схвалило препарат Itvisma – нову генну терапію для пацієнтів зі спінальною м'язовою атрофією (SMA) віком від 2 років з мутаціями SMN1.
Це важливий крок уперед у зусиллях, спрямованих на те, щоб дати більше життя людям з цим рідкісним захворюванням, оскільки вперше генна терапія AAV (використання модифікованого вірусу для доставки терапевтичного гена до клітин або тканин) була схвалена для старшої групи пацієнтів, а не лише для немовлят.
Відповідно, Ітвісма – це одноразова інтратекальна ін’єкційна терапія. Препарат використовує вектор AAV9 для доставки функціональної копії гена SMN1 у рухові нейрони, тим самим допомагаючи підтримувати здатність виробляти білок SMN – життєво важливий фактор для пацієнтів із СМА.
Ітвісма допомагає замінити мутований ген SMN1 , що може уповільнити або зупинити прогресування СМА, дозволяючи пацієнтам підтримувати та покращувати рухову функцію. Завдяки лише «одноразовій» дозі Ітвісма допомагає зменшити навантаження, пов’язане з тривалим лікуванням, що є важливим фактором для якості життя пацієнтів та їхніх сімей.
За словами доктора Х'юя, за умови широкого застосування Ітвісма може відкрити нову надію на життя для багатьох літніх пацієнтів зі СМА, групи, яка раніше мала обмежений доступ до неї, оскільки передові методи лікування були спрямовані переважно на маленьких дітей.
Завдяки методу ін'єкції безпосередньо в спинномозкову рідину, Itvisma забезпечує високу ефективність, передаючи препарат безпосередньо до центральної нервової системи та рухових нейронів, замість внутрішньовенних ін'єкцій, як у попередніх версіях.
У клінічному дослідженні за участю 126 пацієнтів зі СМА віком від 2 до 17 років група, яка приймала Ітвісму, покращила свій стан в середньому на 2,39 бала за шкалою механізму високої мобільності (HFMSE), тоді як група плацебо покращила свій стан лише на 0,51 бала після 48-52 тижнів. Це показує, що препарат значно покращив мобільність у групі, яка ще не могла ходити самостійно.

Випадок рідкісного захворювання СМА (Фото: надано персонажем).
Скільки коштує лікування ?
За словами доктора Хуя, у багатьох міжнародних фінансових звітах зазначено, що ціна препарату Itvisma у США становить близько 2,59 мільйона доларів США за один курс лікування.
Однак, слід наголосити, що це вказана ціна до знижки, без урахування переговорів між лікарнею та фармацевтичною компанією, обов’язкових знижок згідно з нормативними актами, страхових пільг та програм підтримки пацієнтів з низьким рівнем доходу.
Насправді, ціна придбання в лікарнях або страхових компаніях часто значно нижча за вищезазначені витрати. І, незважаючи на високу вартість, порівняно з довгостроковою (річною) вартістю інших методів лікування, Itvisma може бути на 35-46% дешевшим протягом 10-річного циклу.
Представник В'єтнамської організації рідкісних захворювань наголосив, що якщо Itvisma буде впроваджено в майбутньому, це відкриє нові можливості лікування для літніх пацієнтів зі СМА у В'єтнамі.
Доступ залежатиме від багатьох факторів, таких як: переговори щодо цін; створення механізмів фінансової підтримки; оцінка та затвердження імпорту рідкісних лікарських форм; підготовка професійного потенціалу для інтратекальних ін'єкцій та моніторингу ускладнень; а також сприяння скринінгу, щоб допомогти виявляти захворювання на ранній стадії та оперативно втручатися.
«Координація між Міністерством охорони здоров’я , спеціалізованими лікарнями та фондами рідкісних захворювань відіграватиме вирішальну роль у наданні пацієнтам доступу до цієї нової генної терапії. Рання підготовка допоможе в’єтнамським пацієнтам із СМА отримати доступ до передових технологій лікування за більш розумною ціною в майбутньому», – сказав доктор До Фуок Хюй.
Джерело: https://dantri.com.vn/suc-khoe/lan-dau-tien-co-lieu-phap-gen-cho-nguoi-mac-benh-hiem-sma-tu-2-tuoi-tro-len-20251128161139068.htm







































































































Коментар (0)