Die pakistanischen Behörden haben eine vorübergehende Aussetzung der Vermarktung eines Krebsmedikaments (Avastin) des Schweizer Pharmakonzerns Roche zu Untersuchungszwecken angekündigt, nachdem 12 Patienten nach der Injektion des Medikaments erblindet waren.
In Bezug auf diese Informationen gab die vietnamesische Arzneimittelbehörde ( Gesundheitsministerium ) am 27. September bekannt, dass die Repräsentanz von F. Hoffmann La Roche Ltd. eine offizielle Mitteilung mit aktualisierten Informationen zu den Ermittlungen im Zusammenhang mit dem oben genannten Medikament Avastin herausgegeben hat.
In Vietnam verfügt Avastin über vier gültige Zulassungsbescheinigungen für den Vertrieb, und zwar:
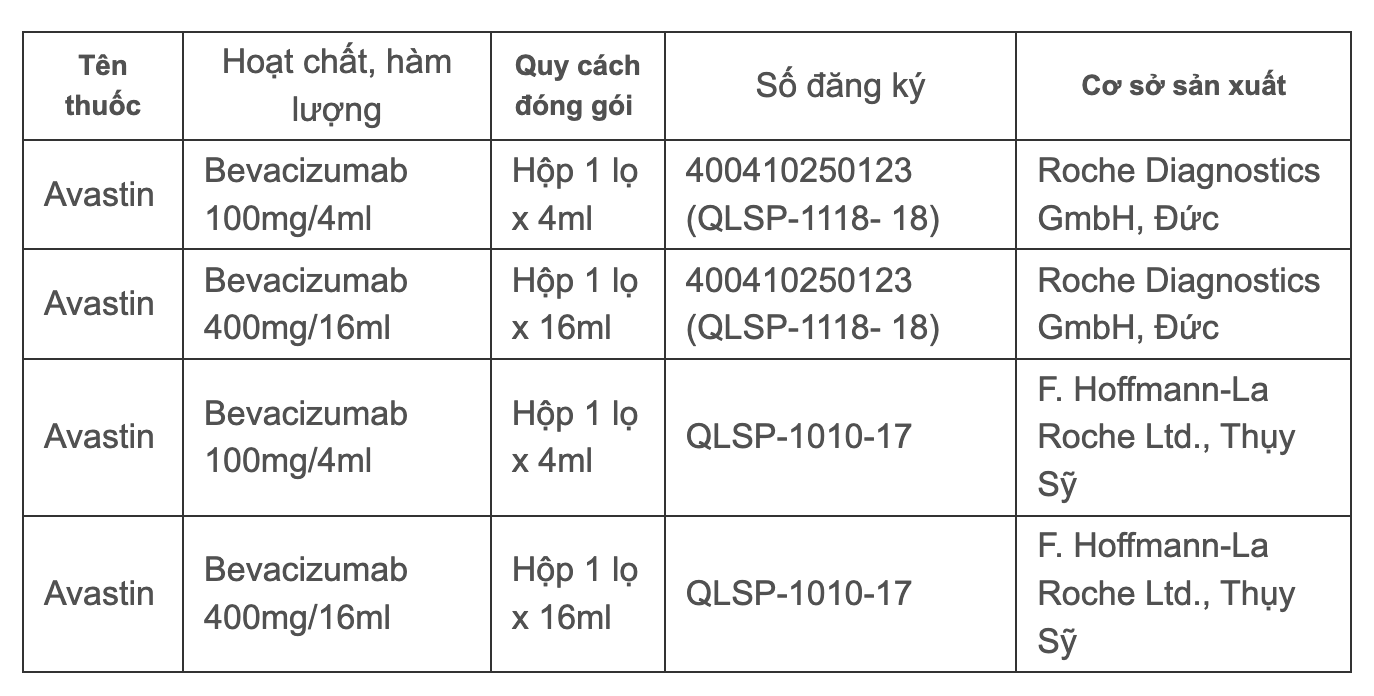
4 gültige Registrierungszertifikate für Avastin
Laut der vietnamesischen Arzneimittelbehörde ist Avastin in Vietnam für die folgenden Behandlungsindikationen zugelassen: Metastasierter Dickdarmkrebs, fortgeschrittener, metastasierter oder rezidivierender nicht-kleinzelliger Lungenkrebs, fortgeschrittenes und/oder metastasiertes Nierenzellkarzinom, Glioblastom/malignes Gliom (Stadium IV), epithelialer Eierstockkrebs, Eileiterkrebs und primärer Peritonealkrebs.
Neben den allgemeinen Warnhinweisen enthält der von der FDA genehmigte Beipackzettel auch den Hinweis, dass das Medikament „nicht zur intravitrealen Injektion verwendet werden darf“. Konkret heißt es: Das Medikament kann Sehstörungen verursachen. Einzelne Fälle und Häufungen schwerwiegender okulärer Nebenwirkungen wurden nach intravitrealer Injektion, einer nicht zugelassenen Verabreichungsart, mit Avastin-Mischungen aus Ampullen, die zur intravenösen Infusion bei Krebspatienten bestimmt sind, berichtet.
Avastin wird zur Behandlung von Krebs eingesetzt.
Zu diesen Reaktionen zählen: Intraokulare Infektion, Endophthalmitis, wie sterile Endophthalmitis, Uveitis und Vitritis, Netzhautbandbildung, Riss des retinalen Pigmentepithels, erhöhter Augeninnendruck, intraokulare Blutungen, wie Glaskörperblutung oder Netzhautblutung, und Bindehautblutung. Mehrere dieser Ereignisse führten zu Sehverlusten unterschiedlichen Ausmaßes, bis hin zur dauerhaften Blindheit.
Ein Vertreter der vietnamesischen Arzneimittelbehörde sagte, dass der Behörde bis zum 27. September keine Berichte über unerwünschte Wirkungen von Avastin im Zusammenhang mit einem Sehverlust bei Patienten nach der Einnahme von Avastin vorlägen.
Laut einem Bericht der Repräsentanz von F. Hoffmann La Roche Ltd. im offiziellen Depeschen Nr. RA/02/09/2023, in dem aktuelle Informationen zu den Ermittlungen im Zusammenhang mit dem Medikament Avastin an die pakistanische Arzneimittelbehörde übermittelt wurden, verloren etwa 12 Patienten ihr Augenlicht, nachdem sie Injektionen des illegalen Lieferanten Genius Pharmaceutical Service erhalten hatten. Diesem Bericht zufolge trägt das Medikament die Bezeichnung „Inj. Avastin 1,25 mg/0,05 ml“, was zu der irreführenden Annahme führt, es handele sich um ein Produkt von Roche.
Avastin von Roche ist nicht für die Anwendung in ophthalmologischen Indikationen zugelassen. Genius Pharmaceutical Service hat das Arzneimittel in einer Dosierung von 1,25 mg/0,5 ml unter unhygienischen und nicht genehmigten Bedingungen geliefert/verdünnt/umverpackt.
[Anzeige_2]
Quelle




![[Foto] Topspieler treffen sich bei der Nhan Dan Newspaper National Table Tennis Championship 2025](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/23/9ad5f6f4faf146b08335e5c446edb107)


![[Foto] Anh Hoang - Dinh Duc verteidigten erfolgreich den Meistertitel im Herrendoppel der Nationalen Tischtennismeisterschaft der Nhan Dan Zeitung](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/23/d6ab3bcac02c49928b38c729d795cac6)




















































































Kommentar (0)