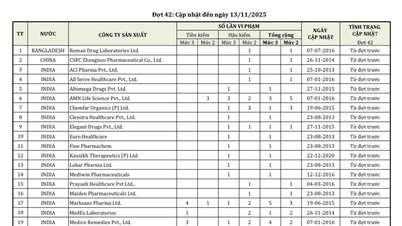
Ennek megfelelően a Vietnami Gyógyszerügyi Hivatal által ezúttal újonnan kiadott vagy megújított forgalomba hozatali és forgalomba hozatali engedélyű közel 600 gyógyszerkészítmény, gyógyszerészeti összetevő és bizonyított bioegyenértékűségű gyógyszer közül 404 belföldön gyártott gyógyszerkészítmény kapott új forgalomba hozatali engedélyt; 42 belföldön gyártott gyógyszer forgalomba hozatali engedélyét újították meg, amelyek közül 26 gyógyszer és gyógyszerészeti összetevő 5 évre, 14 gyógyszer és gyógyszerészeti összetevő pedig 3 évre kapta meg a forgalomba hozatali engedélyét.
Ezzel egyidejűleg 98, bizonyítottan bioekvivalens gyógyszert jelentettek be.
A vietnami gyógyszerügyi hivatal (Drug Administration) előírja a gyógyszergyártó vállalatok számára, hogy tartsák be az Egészségügyi Minisztériumnál regisztrált nyilvántartásokat és dokumentumokat, és hogy a vietnami Egészségügyi Minisztérium által kiadott regisztrációs számot nyomtassák vagy ragasszák a gyógyszer címkéjére.
Teljes mértékben be kell tartani a vietnami törvényeket és az Egészségügyi Minisztérium gyógyszergyártásra és -forgalmazásra vonatkozó rendeleteit.

Az Egészségügyi Minisztérium közel 600 gyógyszert, köztük több tucat bioegyenértékű gyógyszert adott ki és újított meg újonnan...
Ugyanakkor a gyógyszergyártó létesítményeknek biztosítaniuk kell a gyártó létesítmények működési feltételeit a gyógyszer- és gyógyszeralapanyag-forgalmi regisztrációs tanúsítvány érvényességi ideje alatt.
Egyeztessen a kezelőintézményekkel a vényköteles gyógyszerekre vonatkozó jelenlegi előírások betartása érdekében, ellenőrizze a gyógyszerek biztonságosságát, hatékonyságát és a vietnami emberekre gyakorolt káros hatásait, valamint az előírásoknak megfelelően szintetizálja és jelentse azokat.
Különösen azoknál a gyógyszereknél, amelyek forgalomba hozatali engedélyét meghosszabbították, de a gyógyszercímke és a használati utasítás frissítésére irányuló kérelmet nem nyújtották be az előírásoknak megfelelően, a Gyógyszerügyi Hivatal a 01/2018/TTBYT számú körlevél 37. cikkelyének 1. záradékának b) pontjában előírtak szerint a forgalomba hozatali engedély meghosszabbításától számított 12 hónapon belül előírja a frissítést.
Ezenkívül a gyógyszer-nyilvántartási létesítményeknek biztosítaniuk kell a működési feltételek fenntartását a gyógyszer és gyógyszer-alapanyag forgalmi regisztrációs tanúsítvány érvényességi ideje alatt.
Köztudott, hogy a hazai gyártású gyógyszerkészítmények és gyógyszerészeti összetevők, amelyek újonnan kaptak vagy megújították a forgalomba hozatali engedélyüket, farmakológiai hatásuk tekintetében igen változatosak, mint például a légúti fertőzések kezelésére szolgáló gyógyszerek; az osteoarthritis kezelésére szolgáló gyógyszerek...; a szív- és érrendszeri betegségek, a magas vérnyomás, a cukorbetegség, a rák kezelésére szolgáló gyógyszerek, vírusellenes gyógyszerek, antibiotikumok, fájdalomcsillapítók, gyulladáscsökkentők... Emellett a bizonyítottan bioekvivalens gyógyszerek is típusokban változatosak.
Forrás: https://suckhoedoisong.vn/bo-y-te-cap-moi-gia-han-gan-600-thuoc-trong-do-co-hang-chuc-thuoc-tuong-duong-biological-nutrition-169251206123916227.htm


![[Fotó] A Vietnami Fotóművészek Szövetségének alapításának 60. évfordulója](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)
![[Fotó] Tran Thanh Man, a Nemzetgyűlés elnöke részt vesz a VinFuture 2025 díjátadó ünnepségen](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)


































































































Hozzászólás (0)