Ainsi, parmi près de 600 produits pharmaceutiques, ingrédients pharmaceutiques et médicaments à bioéquivalence prouvée ayant obtenu ou renouvelé leurs certificats d'enregistrement et de mise sur le marché auprès de l'Administration des médicaments du Vietnam, 404 produits pharmaceutiques de fabrication nationale ont obtenu de nouveaux certificats d'enregistrement pour la mise sur le marché ; 42 médicaments de fabrication nationale ont vu leurs certificats d'enregistrement renouvelés, dont 26 médicaments et ingrédients pharmaceutiques pour une durée de 5 ans et 14 médicaments et ingrédients pharmaceutiques pour une durée de 3 ans.
Parallèlement, 98 médicaments à la bioéquivalence prouvée ont été annoncés.
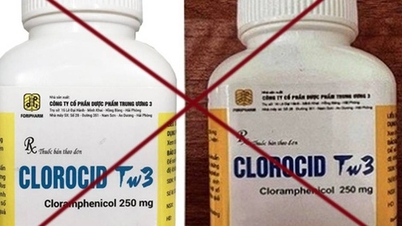
L'Administration vietnamienne des médicaments exige que les entreprises pharmaceutiques se conforment aux registres et documents enregistrés auprès du ministère de la Santé et qu'elles impriment ou apposent le numéro d'enregistrement délivré par le ministère vietnamien de la Santé sur l'étiquette du médicament.
Se conformer pleinement aux lois et réglementations vietnamiennes du ministère de la Santé relatives à la production et à la distribution des médicaments au Vietnam.

Le ministère de la Santé a nouvellement délivré et renouvelé près de 600 médicaments, dont des dizaines de médicaments bioéquivalents...
Dans le même temps, les établissements de fabrication de médicaments doivent garantir les conditions de fonctionnement de l'installation de fabrication pendant la période de validité du certificat d'enregistrement de la circulation du médicament et de ses ingrédients.
Collaborer avec les établissements de soins pour se conformer à la réglementation en vigueur sur les médicaments sur ordonnance, surveiller l'innocuité, l'efficacité et les effets indésirables des médicaments sur la population vietnamienne, et synthétiser et rapporter les données conformément à la réglementation.
En particulier pour les médicaments dont le certificat d'enregistrement de circulation a été prolongé mais pour lesquels la demande de mise à jour de l'étiquetage et du mode d'emploi n'a pas été soumise comme prescrit, le Département de l'administration des médicaments exige une mise à jour conformément au point b, paragraphe 1, article 37 de la circulaire n° 01/2018/TTBYT dans les 12 mois suivant la date de prolongation du certificat d'enregistrement de circulation.
De plus, les établissements d'enregistrement des médicaments doivent veiller à ce que les conditions de fonctionnement soient maintenues pendant toute la durée de validité du certificat d'enregistrement de la circulation du médicament et de ses ingrédients.
Il est connu que les produits pharmaceutiques et les ingrédients pharmaceutiques de fabrication nationale, qui ont récemment obtenu ou dont l'autorisation de mise sur le marché a été renouvelée, présentent une grande diversité en termes d'effets pharmacologiques : médicaments pour traiter les infections des voies respiratoires ; médicaments pour traiter l'arthrose… ; médicaments pour traiter les maladies cardiovasculaires, l'hypertension artérielle, le diabète, le cancer, antiviraux, antibiotiques, analgésiques, anti-inflammatoires… Parallèlement, les médicaments dont la bioéquivalence est prouvée sont également très diversifiés.
Source : https://suckhoedoisong.vn/bo-y-te-cap-moi-gia-han-gan-600-thuoc-trong-do-co-hang-chuc-thuoc-tuong-duong-biological-nutrition-169251206123916227.htm





![[Photo] 60e anniversaire de la fondation de l'Association vietnamienne des artistes photographes](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)
![[Photo] Le président de l'Assemblée nationale, Tran Thanh Man, assiste à la cérémonie de remise des prix VinFuture 2025](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)































































































Comment (0)