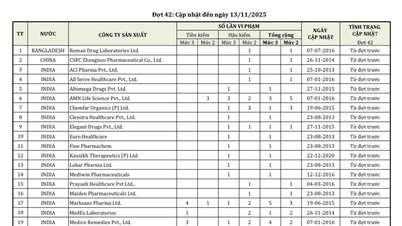
Assim, entre os quase 600 produtos farmacêuticos, ingredientes farmacêuticos e medicamentos com bioequivalência comprovada que receberam ou tiveram seus certificados de registro e circulação renovados pela Administração de Medicamentos do Vietnã desta vez, 404 produtos farmacêuticos de fabricação nacional receberam novos certificados de registro de circulação; 42 medicamentos de fabricação nacional tiveram seus certificados de registro de circulação renovados, dos quais 26 medicamentos e ingredientes farmacêuticos foram renovados por 5 anos e 14 medicamentos e ingredientes farmacêuticos foram renovados por 3 anos.
Além disso, foram anunciados 98 medicamentos com bioequivalência comprovada.
A Administração de Medicamentos do Vietnã exige que as empresas fabricantes de medicamentos cumpram as exigências de registros e documentos junto ao Ministério da Saúde e que imprimam ou afixem o número de registro emitido pelo Ministério da Saúde vietnamita no rótulo do medicamento.
Cumprir integralmente as leis e regulamentos vietnamitas do Ministério da Saúde relativos à produção e circulação de medicamentos no Vietnã.

O Ministério da Saúde emitiu e renovou a autorização de quase 600 medicamentos, incluindo dezenas de medicamentos bioequivalentes...
Ao mesmo tempo, as instalações de fabricação de medicamentos devem garantir as condições operacionais da instalação de fabricação durante o período de validade do certificado de registro de circulação do medicamento e do ingrediente farmacêutico.
Coordenar com as unidades de tratamento para garantir o cumprimento das normas vigentes sobre medicamentos controlados, monitorar a segurança, a eficácia e os efeitos adversos dos medicamentos na população vietnamita, e sintetizar e relatar as informações de acordo com as regulamentações.
Particularmente para medicamentos cujo certificado de registro de circulação foi prorrogado, mas o pedido de atualização da bula e das instruções de uso não foi apresentado conforme prescrito, o Departamento de Administração de Medicamentos exige a atualização conforme previsto no item b, cláusula 1, artigo 37 da Circular nº 01/2018/TTBYT, no prazo de 12 meses a partir da data de prorrogação do certificado de registro de circulação.
Além disso, os estabelecimentos de registro de medicamentos devem garantir que as condições de funcionamento sejam mantidas durante o período de validade do certificado de registro de circulação do medicamento e do ingrediente farmacêutico.
Sabe-se que os produtos farmacêuticos e ingredientes farmacêuticos produzidos internamente, que tiveram seus registros de circulação recentemente aprovados ou renovados, são bastante diversos em termos de efeitos farmacológicos, como medicamentos para o tratamento de infecções do trato respiratório; medicamentos para o tratamento da osteoartrite; medicamentos para o tratamento de doenças cardiovasculares, hipertensão, diabetes, tratamento do câncer, medicamentos antivirais, antibióticos, analgésicos, anti-inflamatórios... Além disso, os medicamentos com bioequivalência comprovada também são diversos em termos de tipos.
Fonte: https://suckhoedoisong.vn/bo-y-te-cap-moi-gia-han-gan-600-thuoc-trong-do-co-hang-chuc-thuoc-tuong-duong-biological-nutrition-169251206123916227.htm




![[Foto] 60º aniversário da fundação da Associação Vietnamita de Artistas Fotográficos](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)


![[Foto] O presidente da Assembleia Nacional, Tran Thanh Man, participa da cerimônia de premiação do VinFuture 2025.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)
































































































Comentário (0)