Die US-amerikanische Arzneimittelbehörde FDA hat eine revolutionäre Gen-Editing-Therapie zur Behandlung der Sichelzellanämie zugelassen.
Die Entscheidung der FDA fiel am 9. Dezember. Die beiden zugelassenen Therapien heißen Casgevy, das auf der mit dem Nobelpreis ausgezeichneten CRISPR-Geneditierungstechnologie basiert, und Lyfgenia, das ein harmloses Virus zur Genbearbeitung verwendet.
Casgevy wird von zwei Unternehmen hergestellt: Vertex Pharmaceuticals (USA) und CRISPR Therapeutics (Schweiz). Das Medikament repariert defekte Gene in Stammzellen von Patienten ab 12 Jahren mit Sichelzellanämie und Thalassämie.
Beide Erkrankungen werden durch Defekte im Hämoglobin-Gen verursacht. Gentherapien kosten üblicherweise Millionen von Dollar und sind daher für viele Patienten unerschwinglich. Der Hersteller Vertex Pharmaceuticals arbeitet daran, den Preis so niedrig wie möglich zu halten.
Die FDA-Zulassung erfolgte, nachdem die britische Arzneimittelbehörde MHRA die Therapie im November zugelassen hatte.
Lyfgenia nutzt Gentransfer zur Genbearbeitung. Dabei werden die Blutstammzellen eines Patienten so verändert, dass sie Hämoglobin produzieren, das vom entsprechenden Gen abgeleitet ist. Laut FDA reduziert dieses Hämoglobin, wenn es den roten Blutkörperchen beigemischt wird, das Risiko einer Sichelzellanämie.
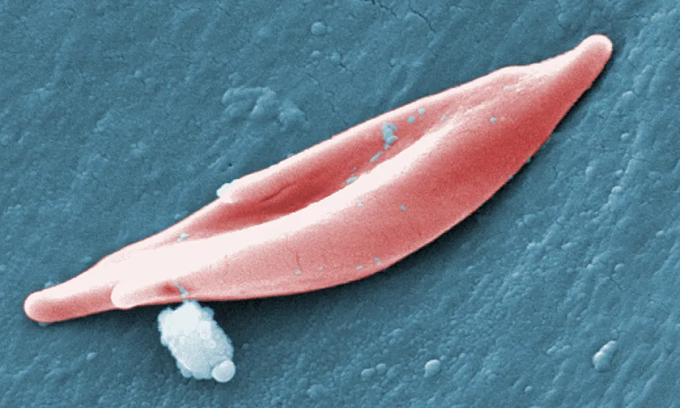
Ein sichelförmiges rotes Blutkörperchen. Foto: CDC
„Dies sind bedeutende Fortschritte auf dem Gebiet der Gentherapie für Patienten mit Sichelzellanämie. Ihr Potenzial, Leben zu verändern, ist enorm“, sagte Peter Marks, Direktor des Zentrums für Biologika-Bewertung und -Forschung der FDA.
Laut Dr. Nicole Verdun von der FDA ermöglicht die Gentherapie eine gezieltere und effektivere Behandlung, insbesondere für Menschen mit seltenen Krankheiten, denen nur begrenzte Behandlungsmöglichkeiten zur Verfügung stehen.
Die FDA freue sich sehr, diesen Bereich voranzubringen, fügte sie hinzu, da er Menschen helfe, deren Leben durch die Krankheit stark beeinträchtigt sei.
Die Zulassung durch die Behörde bedeutet, dass rund 16.000 Menschen mit Sichelzellanämie eine mögliche Behandlungsoption erhalten. Die Krankheit betrifft etwa 100.000 Amerikaner und mehr als 7,7 Millionen Menschen weltweit, überwiegend afrikanischer und karibischer Abstammung. Es handelt sich um eine seltene, schwächende und lebensbedrohliche Blutkrankheit, und viele Betroffene haben einen ungedeckten Behandlungsbedarf.
Bei Patienten mit Sichelzellanämie sind die Blutzellen länglich und sichelförmig, anstatt der üblicherweise runden, konkav geformten Blutzellen. Diese deformierten Zellen verstopfen die Blutgefäße, blockieren die Sauerstoffversorgung und verursachen so starke Schmerzen, Schlaganfälle und Organschäden.
Thuc Linh (laut AFP, AP )
Quellenlink




![[Foto] 60. Jahrestag der Gründung des vietnamesischen Verbandes der Fotokünstler](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764935864512_a1-bnd-0841-9740-jpg.webp&w=3840&q=75)

![[Foto] Der Vorsitzende der Nationalversammlung, Tran Thanh Man, nimmt an der VinFuture 2025 Preisverleihung teil.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F05%2F1764951162416_2628509768338816493-6995-jpg.webp&w=3840&q=75)














![[Infografik] Luftverschmutzung und Empfehlungen des Gesundheitsministeriums](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/12/05/1764950568593_screen-shot-2025-12-05-at-222015-png.webp)

























































































Kommentar (0)